 |
Загальна характеристика ферментів як біологічних каталізаторів
Дата добавления: 2014-07-26 | Просмотров: 1655
|
|
Ферменти, як було встановлено ще у 1922 р., є білками. Їхня роль унікальна: вони збільшують швидкість перебігу хімічної реакції, але при цьому не використовуються. У 1926 р. був вперше очищений і виділений фермент уреаза, що каталізує реакції розщеплення сечовини до аміаку і діоксиду вуглецю. До сьогодні у кристалічному вигляді отримані сотні різних ферментів, розшифровані їхні амінокислотні послідовності, вивчається їхня роль у метаболічних перетвореннях.
У ролі біокаталізаторів можуть виступати і небілкові сполуки. Наприклад, деякі типи РНК викликають гідроліз фосфодиефірних зв’язків нуклеїнових кислот. Такі молекули РНК з каталітичною активністю називають рибозимами, однак їхній вклад у хімічне перетворення сполук є набагато меншим, ніж ферментів.
Оскільки ферменти – білкові молекули, їм притаманні усі властивості, що характерні для білків. В той же час вони мають особливості будови, що характеризують їх як каталізатори. Розглянемо основні властивості ферментів як біологічних каталізаторів.
Специфічність
Біологічна функція ферменту як і будь-якого білка, обумовлена наявністю в його структурі активного центру. Ліганд, що взаємодіє з активним центром ферменту, називають субстратом. У активному центрі ферменту є амінокислотні залишки, функціональні групи яких забезпечують зв’язування субстрату, і амінокислотні залишки, функціональні групи яких здійснюють хімічне перетворення субстрату. Умовно ці групи позначають як ділянку зв’язування субстрату і каталітичну ділянку, але потрібно пам’ятати, що не завжди ці ділянки мають чітке просторове розмежування, іноді вони можуть «перекриватися» (рис. 1).
В ділянці зв’язування субстрат за допомогою нековалентних зв’язків взаємодіє (зв’язується) з ферментом, формуючи ферментсубстратний комплекс. У каталітичній ділянці субстрат піддається хімічному перетворенню на продукт, який потім вивільнюється з активного центру ферменту. Схематично процес каталізу можна представити наступним рівнянням:
E + S ↔ ES ↔ EP ↔ E + P,
де Е – фермент (ензим), S – субстрат, Р – продукт. Наведені позначення є загальноприйнятими і походять від англійських слів enzyme, substrat, product.

| Рис. 1. | Будова активного центру ферменту: А – приєднання субстрату до ферменту в активному центрі; Б – положення амінокислотних залишків, що формують активний центр ферменту, в первинні структурі білка; В – активний центр ферменту умовно поділяється на ділянку зв’язування та каталітичну ділянку. Ділянка зв’язування представлена радикалами амінокислот, функціональні групи яких забезпечують зв’язування субстрату. Каталітична ділянка утворена радикалами амінокислотних залишків, функціональні групи яких забезпечують хімічне перетворення субстрату. |
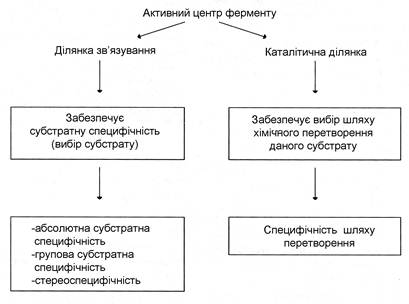
Специфічність – найбільш важлива властивість ферментів, що визначає біологічну важливість цих молекул. Розрізняють субстратну і каталітичну специфічності ферменту, що визначаються будовою активного центру (рис. 2).
Під субстратною специфічністю розуміють здатність кожного ферменту взаємодіяти лише з одним або декількома певними субстратами.
| Рис. 2. | Функціональна значимість окремих ділянок активного центру ферменту |
Розрізняють:
- абсолютну субстратну специфічність;
- групову субстратну специфічність;
- стереоспецифічність.
Активний центр ферментів, якому притаманна абсолютна субстратна специфічність, є комплементарним лише до одного субстрату. Потрібно зазначити, що таких ферментів у живих організмах мало.
Приклад ферменту з абсолютною субстратною специфічністю є аргіназа, що каталізує розщеплення аргініну до сечовини і орнітину:

аргінін орнітин сечовина
Інший приклад ферменту з абсолютною субстратною специфічністю – уреаза, що каталізує гідроліз сечовини до діоксиду вуглецю і аміаку:

Більшість ферментів каталізує однотипні реакції з невеликою кількістю (групою) структурно схожих субстратів. Так, фермент панкреатична ліпаза каталізує гідроліз жирів у дванадцятипалій кишці людини, каталізуючи перетворення будь-якої молекули жиру (триацилгліцеролу) до молекули моноацилгліцеролу і двох молекул вищих жирних кислот. Панкреатична ліпаза гідролізує ефірний зв’язок біля α-атомів вуглецю гліцеролу, незалежно від того, які жирні кислоти входять до складу молекули жиру:
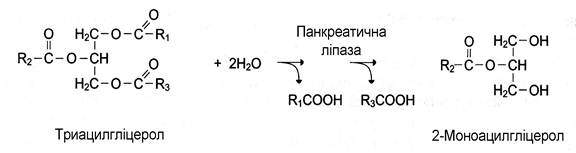
Більшість протеолітичних ферментів, що здійснюють гідроліз білків, має групову субстратну специфічність. Ензими гідролізують пептидні зв’язки, що є утворені різними амінокислотами.
Стереоспецифічність. При наявності у субстраті декількох стереоізомерів фермент проявляє абсолютну специфічність до одного з них. В організмі людини спостерігають специфічність ферментів до наступних стереоізомерів: D-цукрів, L-амінокислот, цис-транс-ізомерів, α- і β-глікозидних зв’язків.
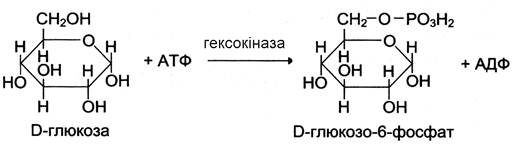
Більшість моноцукрів і продуктів їхнього обміну в організмі людини та інших ссавців належать до D-стереоізомерів. Ферменти, що здійснюють їхній метаболізм, мають специфічність до D-, а не до L-цукрів:
Білки людини складаються з амінокислот L-ряду. Більшість ферментів, що забезпечують перетворення амінокислот, має стереоспецифічність до L-амінокислот.
Фермент фумараза діє тільки на фумарат. Малеїнат (цис-ізомер фумарату) не є субстратом фумарази:

Виключення складають тільки ферменти епімерази (рацемази), що каталізують перетворення оптичних ізомерів.
Фермент амілаза діє тільки на α-глікозидні зв’язки, що дозволяє гідролізувати крохмаль і глікоген (полімери глюкози), залишки яких сполучені α-глікозидними зв’язками. Целюлоза – теж полімер глюкози, але залишки глюкози в ній сполучені β-глікозидними зв’язками. В результаті відсутності у людини ферментів, які специфічно розщеплюють β-глікозидний зв’язок, целюлоза не гідролізується у кишечнику людини і не може служити джерелом глюкози.
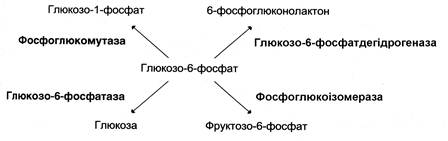
Фермент каталізує перетворення приєднаного субстрату за одним з можливих шляхів його перетворення. Ця властивість забезпечується будовою каталітичної ділянки активного центру ферменту і називається каталітичною специфічністю, або специфічністю шляху перетворення субстрату. Так, молекула глюкозо-6-фосфату у клітинах печінки людини – субстрат 4 різних ферментів: фосфоглюкомутази, глюкозо-6-фосфатфосфатази, фосфоглюкозо-ізомерази і глюкозо-6-фосфатдегідрогенази. Але через особливості будови каталітичних ділянок цих ферментів відбувається різне перетворення цієї сполуки з утворенням 4 різних продуктів:
Каталітична ефективність
Більшість реакцій, що каталізуються ензимами, є високоефективними, вони відбуваються у 108–1014 разів швидше, ніж неферментативні реакції. Кожна молекула ферменту здатна за секунду трансформувати від 100 до 1000 молекул субстрату на продукт.
Кількість молекул субстрату, перетворених на продукт за допомогою однієї молекули ферменту за 1 с, називають числом обертів ферменту, або молярною активністю.
Лабільність ферментів
Каталітична ефективність ферменту, як і будь-якої іншої білкової молекули, залежить від його конформації, і зокрема від конформації активного центру.
Для ферментів є характерною конформаційна лабільність – здатність до незначних змін нативної конформації внаслідок розриву слабких зв’язків. Тому вплив денатуруючих агентів, здатних змінювати конформацію ферменту, призводить до зміни конформації активного центру і зниження здатності приєднувати субстрат. В результаті цього зменшується каталітична активність ферменту.
Здатність ферментів до регуляції
Активність ферментів у клітині залежить від кількості молекул субстрату, продукту, наявності кофакторів і коферментів. Дія ферментів у клітині, як правило, точно впорядкована: продукт однієї ферментативної реакції є субстратом іншої, утворюючи таким чином «метаболічні шляхи». Серед великої кількості ферментів практичного кожного метаболічного шляху розрізняють ключові, або регуляторні, ферменти, активність яких може змінюватися в залежності від потреби клітини у кінцевому продукті метаболічного шляху. Регуляторні ферменти розміщені, як правило, на початку і/або у місці розгалуження метаболічного шляху. Вони каталізують або найповільніші (швидкість-лімітуючі реакції), або необоротні реакції. Докладно про те, як здійснюється контроль метаболізму шляхом регуляції активності ферментів, описано у підрозділі 7.