 |
Кофактори та коферменти
Дата добавления: 2014-07-26 | Просмотров: 1879
|
|
Більшість ферментів для прояву ферментативної активності потребує низькомолекулярних органічних сполук небілкової природи (коферменти) і/або йони металів (кофактори).
Термін «кофермент» був введений на початку ХХ ст. і позначав частину деяких ферментів, яка легко відділялася від білкової молекули ферменту і видалялася через напівпроникну мембрану під час діалізу. Дещо пізніше було встановлено, що більшість ферментів складається з термолабільної білкової частини і термостабільного небілкового фактору – коферменту. Білкова частина отримала назву «апофермент», який за відсутністю коферменту не володіє каталітичною активністю. Кофермент з білковою молекулою (апоферментом) формують молекулу холоферменту, що володіє каталітичною активністю.
Кофактори
Більше 25% всіх ферментів для прояву повної каталітичної активності потребують наявності іонів металів. Розглянемо роль кофакторів у ферментативному каталізі.
Йони металу виконують функцію стабілізаторів молекули субстрату, активного центру ферменту і конформації білкової молекули ферменту, а саме третинної і четвертинної структур.
Йони металів – стабілізатори молекули субстрату. Для деяких ферментів субстратом слугує комплекс перетворюваної речовини з йоном металу. Наприклад, для більшості кіназ у якості одного з субстратів виступає не молекула АТФ, а комплекс Mg2+-АТФ. В цьому випадку йон Mg2+ не взаємодіє безпосередньо з ферментом, а задіяний у стабілізації молекули АТФ і нейтралізації від’ємного заряду субстрату, що полегшує його приєднання до активного центру ферменту:

Схематично роль кофактору під час взаємодії ферменту і субстрату можна представити як комплекс E–S–Me, де Е – фермент, S – субстрат, Ме – йон металу.
В якості прикладу можна навести розміщення субстратів в активному центрі гексокінази (рис. 3).

| Рис. 3. | Участь іонів магнію в приєднанні субстрату в активному центрі гексокінази. В активному центрі гексокінази є ділянки зв’язування для молекули глюкози і комплексу Mg2+-АТФ. У результаті ферментативної реакції відбувається перенесення кінцевого, γ-фосфатного залишку молекули АТФ на глюкозу з утворенням глюкозо-6-фосфату. |
Гексокіназа каталізує перенесення кінцевого, γ-фосфатного залишку молекули АТФ на глюкозу з утворенням глюкозо-6-фосфату:

Іон Mg2+ бере участь у приєднанні й «правильній» орієнтації молекули АТФ в активному центрі ферменту послаблюючи фосфоефірний зв’язок і полегшуючи перенесення фосфату на глюкозу.
Йони металу – стабілізатори активного центру ферменту. В деяких випадках йони металу слугують «містком» між ферментом і субстратом. Вони виконують функцію стабілізаторів активного центру полегшуючи приєднання до нього субстрату і протікання хімічної реакції. У частині випадків йон металу може сприяти приєднанню коферменту. Перераховані вище функції виконують такі метали, як Mg2+, Mn2+, Zn2+, Co2+, Mo2+. За відсутності металу ці ферменти не активні. Такі ферменти отримали назву «металоензими». Схематично даний процес взаємодії ферменту, субстрату і металу можна зобразити наступним чином: Е – Ме – S.
До металоензимів належить, наприклад, фермент піруваткіназа (рис. 4), що каталізує реакцію:


| Рис. 4. | Участь йонів магнію в приєднанні субстрату в активному центрі піруваткінази. Активний центр піруваткінази має ділянки зв’язування для фосфоенолпірувату й АДФ. Mg2+ бере участь у стабілізації активного центру, що полегшує приєднання фосфоенолпірувату. Внаслідок ферментативної реакції утворюється піруват і АТФ. |
Йони металів забезпечують зберігання вторинної, третинної, четвертинної структури молекули ферменту. Такі ферменти за відсутності йонів металів здатні до хімічного каталізу, але вони є нестабільними. Їхня активність знижується і навіть повністю зникає внаслідок невеликих змін рН, температури та інших незначних змін зовнішнього середовища. Таким чином, йони металів виконують функцію стабілізаторів оптимальної конформації білкової молекули.
Іноді у стабілізації вторинної і третинної структури приймають участь йони лужних і лужно-земельних металів. Так, для підтримання третинної конформації піруваткінази потрібні йони К+.
Для стабілізації четвертинної структури алкогольдегідрогенази, що каталізує реакцію окислення етанолу, необхідні йони цинку. Алкоголь-дегідрогеназа складається з чотирьох субодиниць з молекулярною масою 151 кД. До складу ферменту входять 4 атоми Zn2+. Видалення Zn2+ призводить до втрати ферментом активності за рахунок дисоціації на 4 неактивні субодиниці з молекулярною масою 36 кД (рис. 5).

| Рис. 5. | Стабілізація четвертинної структури алкогольдегідрогенази іонами цинку |
Роль металів у ферментативному каталізі. Не менш важлива роль відводиться йонам металів в здійсненні ферментативного каталізу.
Під час електрофільного каталізу йони металів часто приймають участь в стабілізації проміжних сполук. Найчастіше цю функцію виконують йони металів зі змінною валентністю, що мають вільну d-орбіталь і виступають в якості електрофілів. Це в першу чергу такі метали, як Zn2+, Fe2+, Mn2+, Cu2+. Йони лужних металів, такі як Na+ і К+ не володіють такою властивістю. У якості прикладу можна розглянути функціонування ферменту карбоангідрази. Карбоангідраза – цинквмісний фермент, що каталізує реакцію утворення вугільної кислоти:
СО2 + Н2О ↔ Н2СО3.
Йон Zn2+ в результаті гідрофільної атаки цинк-ензиму приймає участь в утворенні Н+ і ОН– йонів з молекули води:

Протон і гідроксильна група послідовно приєднуються до діоксиду вуглецю з утворенням вугільної кислоти:
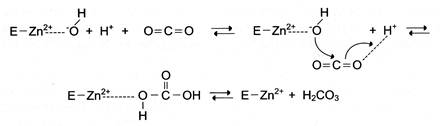
Йони металів зі змінною валентністю можуть також приймати участь в перенесенні електронів. Наприклад, у цитохромах (гемвмісних білках) йон заліза здатен приєднувати і віддавати один електрон:

Завдяки цій властивості, цитохроми приймають участь в окисно-відновних реакціях.
Інший приклад участі йонів металів в окисно-відновних реакціях – робота ферменту дофамінгідроксилази, що каталізує реакцію утворення норадреналіну за участю вітаміну С:

За окисно-відновні властивості дофамінгідроксилази відповідає йон міді (рис. 6).
Фрагмент, що містить йон Cu2+, не вступає в реакцію з молекулою кисню. Під час відновлення Cu2+ до Cu+ за допомогою аскорбінової кислоти утворюється йон міді, здатний взаємодіяти з киснем з утворенням перекисної сполуки. Далі гідроксильна група переноситься на молекулу дофаміну з утворенням норадреналіну.

| Рис. 6. | Участь йону міді в активації молекули кисню під час функціонування дофамінгідроксилази: 1 – відновлення Cu2+, що входить до складу активного центру дофамінгідроксилази, до Cu+ за допомогою аскорбінової кислоти; 2 – взаємодія Cu+ з киснем з утворенням перекісної сполуки; 3 – перенесення гідроксильної групи на молекулу дофаміну з утворенням норадреналіну. |
Роль металів у регуляції активності ферментів. Іноді йони металів виступають у ролі регуляторних молекул. Наприклад йони Cа2+ слугують активаторами ферменту протеїнкінази С, що каталізує реакції фосфорилювання білків. Йони Cа2+ також змінюють активність ряду кальцій-кальмодулінзалежних ферментів.
Коферменти
Як вже було зазначено для прояву каталітичної активності більшості ферментів необхідною є наявність коферменту. Виключення складають гідролітичні ферменти (наприклад, протеази, ліпази, рибонуклеаза), що виконують свою функцію за відсутності коферменту.
Кофермент, локалізуючись у каталітичній ділянці активного центру, приймає безпосередню участь в хімічній реакції, виступаючи у якості акцептора і донора хімічних груп, атомів, електронів. Кофермент може бути зв’язаним з білковою частиною молекули ковалентними і нековалентними зв’язками. У першому випадку він називається простетичною групою (наприклад, FAD, FMN, біотин, ліпоєва кислота). Разом з тим відомі приклади, коли кофермент приєднується до ферменту нековалентними зв’язками настільки міцно, що не дисоціює від білкової молекули, наприклад тіаміндифосфат.
У другому випадку кофермент взаємодіє з ферментом тільки під час хімічної реакції і може розглядатися у якості другого субстрату. Приклади – NAD+, NADP+.
Апофермент забезпечує специфічність дії і відповідає за вибір типу хімічного перетворення субстрату. Один і той же кофермент, взаємодіючи з різними апоферментами, може приймати участь у різних хімічних перетвореннях субстрату. Наприклад, піридоксальфосфат в залежності від того, з яким апоферментом він взаємодіє, приймає участь у реакціях трансамінування або карбоксилювання амінокислот.
Хімічна природа коферментів, їхні функції у ферментативних реакціях є надзвичайно різноманітними. Традиційно до коферментів відносять похідні вітамінів, хоча крім них існує значний клас небілкових сполук, що приймають участь у прояві каталітичної функції ферментів.
До коферментів належать наступні сполуки:
· похідні вітамінів;
· геми, що входять до складу цитохромів, каталази, пероксидази, гуанілатциклази, NO-синтази і є простетичною групою ферментів;
· нуклеотиди – донори і акцептори залишку фосфорної кислоти;
· убіхінон, або кофермент Q, що задіяний у перенесенні електронів і протонів у дихальному ланцюзі;
· фосфоаденозилфосфосульфат, що приймає участь у перенесенні сульфату;
· S-аденозилметіонін (SAM) – донор метильної групи;
· глутатіон, що приймає участь в окисно-відновних реакціях.
Будова і функції цих коферментів докладно розглянуті у відповідних розділах підручника.
Мультисубстратні реакції
Більшість ферментів каталізує реакції, в яких приймає участь більше одного субстрату. У випадку якщо кофермент не є простетичною групою, його також можна розглядати як ще один субстрат. Отже, учасників ферментативної реакції може бути декілька: безпосередньо фермент, кілька субстратів і кофермент.
У таких випадках механізм ферментативної реакції, як правило, може відбуватися за одним з двох шляхів: за механізмом «пінг-понг» (механізм подвійного заміщення) або послідовним. Розглянемо обидва механізми.
Схематично механізм «пінг-понг» можна зобразити наступним чином:

Субстрат А, взаємодіючи з ферментом (Е), перетворюється на продукт (Р1). У результаті цього перетворення фермент залишається не в нативній формі, а в зміненій (Е') у результаті модифікації коферменту. Далі до активного центру Е' приєднується субстрат В, що перетворюється на продукт (Р2) із вивільненням нативної форми ферменту Е.
Гарний приклад механізму «пінг-понг» – реакції трансамінування за участю ферментів амінотрансфераз (кофермент – піридоксальфосфат). Амінотрансферази, відкриті радянським вченим А.Е. Браунштейном, каталізують оборотні реакції перенесення аміногрупи з амінокислоти на кетокислоту. Механізм «пінг-понг» даної реакції схематично представлений на рис. 7.

| Рис. 7. | Події в активному центрі амінотрансферази як приклад механізму «пінг-понг» Кофермент піридоксальфосфат (ПФ), зв’язаний з ферментом, приймає α-аміногрупу від першої амінокислоти (АК1), яка при цьому перетворюється на α-кетокислоту 1 (КК1) і вивільнюється з активного центру ферменту. Далі до активного центру ферменту приєднується α-кетокислота 2 (КК2), яка забирає аміногрупу від коферменту і перетворюється на α-амінокислоту (АК2). |
Інший приклад механізму «пінг-понг» – реакції дегідрування за участю коферменту FAD (флавінаденіндинуклеотид) або FMN (флавінмоно-нуклеотид), які міцно зв’язані з ферментом і, відповідно, не можуть розглядатися в якості другого субстрату.
Схематично структура цих коферментів і відповідні їм хімічні формули наведені на рис. 8.

| Рис. 8. | Структура (А) і хімічна будова (Б) коферментів FMN і FAD |
FMN і FAD приймають участь в окисно-відновних реакціях, акцептуючи 2 е– і 2 Н+ в ізоалаксазинове кільце:

Схему реакції дегідрування (як приклад механізму «пінг-понг» за участю коферментів FAD і FMN) можна представити наступним чином:

де АН2 – донор водню, що окислює субстрат 1; А – окислена форма субстрату 1; В – акцептор водню – субстрат 2; ВН2 – відновлена форма субстрату 2, (FAD), (FADH2) – окислена й відновлена форми коферменту FAD, що входить до складу ферменту Е.
В якості прикладу FAD-залежної реакції можна привести сукцинат-дегідрогеназну реакцію. В цій реакції у якості другого субстрату задіяний убіхінон – один з посередників у дихальному ланцюзі:

У випадку послідовного механізму для перебігу ферментної реакції потрібна одночасна взаємодія двох субстратів. В такому випадку можливе приєднання субстратів двома різними шляхами:
1) Механізм впорядкованої взаємодії субстрату з активним центром ферменту:

Першим до активного центру ферменту приєднується субстрат А, полегшуючи приєднання субстрату В. Після хімічної модифікації також спостерігають певний порядок вивільнення продуктів реакції.
2) Механізм випадкової взаємодії субстрату з активним центром ферменту:

Пріоритетності у взаємодії субстратів А і Б з активним центром ферменту немає (кожен субстрат має свій центр зв’язування у активному центрі). Також немає чіткої закономірності у вивільненні продуктів реакції.
Прикладом послідовного впорядкованого механізму може бути реакція дегідрування за участю коферментів NAD+, NADP+.
Схематично структура і хімічні формули цих коферментів наведені на рис. 9.

| Рис. 9. | Структура (А) і хімічна будова (Б) коферментів NAD+ і NADP+ |
Обидва коферменти функціонують як посередники у перенесенні двох електронів і одного протону від донора до акцептора, і другого протону – в середовище:

Донор і акцептор не обов’язково приймають участь в одному метаболічному шляху. Іншими словами, відновлена форма цих нуклеотидів діє як загальний пул електронів, утворений в результаті окисних реакцій, і може бути використана в різних відновних реакціях. Такі реакції називають спряженими:
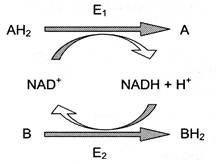
де АН2 – донор водню, відновлена форма субстрату 1; А – окислена форма субстрату 1; В – акцептор водню – другий субстрат; ВН2 – відновлена форма субстрату 2; NAD+, NADH – окислена і відновлена форми коферменту; Е1 і Е2 – ферменти.
Дві ферментативні реакції, що каталізуються ферментами Е1 і Е2, спряжені одна з одною за допомогою NAD+, що слугує субстратом у кожному з цих випадків. Для першого ферменту субстратом є окислена форма NAD+, у якості другого субстрату виступає донор водню (приклад послідовних реакцій), а продуктом є відновлена форма NAD; для Е2 – навпаки.
Як приклад можна розглянути наступні спряжені реакції (схема нижче), де Е1 – гліцеральдегідфосфатдегідрогеназа, Е2 – лактатдегідро-геназа.
