 |
Основи кінетики ферментативних реакцій
Дата добавления: 2014-07-26 | Просмотров: 1863
|
|
Кінетика ферментативних реакцій – розділ ензимології, що вивчає залежність швидкості хімічних реакцій, які каталізуються ферментами, від хімічної природи реагуючих речовин, а також від факторів оточуючого середовища.
Для вимірювання каталітичної активності ферментів використовують такі показники, як швидкість реакції або активність ферменту. Швидкість ферментативної реакції визначається зміною кількості молекул субстрату або продукту за одиницю часу. Швидкість ферментативної реакції – міра каталітичної активності ферменту, її позначають як активність ферменту.
Математично швидкість ферментативної реакції виражається у зміні концентрації субстрату (зменшення) або продукту (збільшення) за одиницю часу:
V = d[S]/t = d[P]/t.
На початковому етапі [t0 – t1] швидкість реакції є прямопропорційною часу і має лінійну залежність. Графічно зміну швидкості ферментативної реакції визначають тангенсом кута нахилу дотичної до кривої профілю реакції. Чим більшим є кут нахилу, тим більша зміна швидкості реакції (рис. 15).

| Рис. 15. | Залежність накопичення продукту (А) і витрати субстрату (Б) від часу (тривалості) протікання реакції: Швидкість ферментативної реакції визначається зміною концентрації продукту або субстрату за одиницю часу. В реакціях, які каталізуються ферментами 1 і 2, початкова швидкість реакції, каталізованої ферментом 1, є нижчою, ніж швидкість реакції, каталізованої ферментом 2, тому що тангенс кута нахилу дотичної до кривої профілю реакції, проведеної з точки «0», у другого ферменту вищий, як у випадку накопичення продукту (А), так і у випадку витрати субстрату (Б). Швидкість у будь-який момент часу t визначається тангенсом кута нахилу дотичної до профілю реакції у момент часу t. Період часу ферментативної реакції [t1 – t0] характеризується лінійним накопиченням продукту (або витратою субстрату) в залежності від тривалості реакції. Період ферментативної реакції [t1 – tх] характеризується нелінійним накопиченням продукту (або витратою субстрату) в залежності від часу реакції. |
Після певного часу зміна швидкості ферментативної реакції в експериментальних умовах зменшується, про що свідчить зміна кута нахилу дотичної у момент часу t. Зниження швидкості ферментативної реакції може відбуватися за рахунок ряду факторів: зменшення концентрації субстрату, збільшення концентрації продукту, який може проявляти інгібуючу дію, можуть відбуватися зміни рН розчину, інактивація ферменту тощо.
На етапі [t1 – tх] швидкість реакції змінюється нелінійно в залежності від часу. Тому для визначення швидкості ферментативної реакції найчастіше досліджують зміни швидкості на початковому етапі [t0 – t1], де спостерігають лінійну зміну концентрації продукту (або субстрату). Швидкість ферментативної реакції залежить від ряду факторів, таких як кількість і активність ферментів, концентрація субстрату, температура середовища, рН розчину, присутність регуляторних молекул (активаторів та інгібіторів). Розглянемо вплив цих факторів на швидкість ферментативної реакції.
Залежність швидкості ферментативної реакції
від концентрації ферментів
Під час проведення ферментативної реакції в умовах надлишку субстрату швидкість реакції буде залежати від концентрації ферменту. Графічна залежність такої реакції має вигляд прямої лінії (рис. 16).
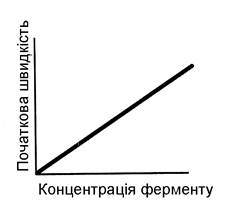
| Рис. 16. | Залежність швидкості ферментативної реакції (V) від концентрації ферменту |
Але кількість ферменту часто неможливо визначити в абсолютних величинах, тому на практиці використовують умовні величини, які характеризують активність ферменту: одна міжнародна одиниця активності (МО) відповідає такій кількості ферменту, яка каталізує перетворення 1 мкмоль субстрату за 1 хвилину за оптимальних умов проведення ферментативної реакції. Оптимальні умови є індивідуальними для кожного ферменту і залежать від температури середовища, рН розчину, за відсутності активаторів та інгібіторів.

Кількість одиниць активності nМО визначають за формулою:

У 1973 р. була прийнята нова одиниця активності ферментів: 1 катал (кат), що відповідає такій кількості каталізатора, яка перетворює 1 моль субстрату за 1 с. Кількість каталів визначають за формулою:

Міжнародна одиниця ферментативної активності МО пов’язана з каталом наступними рівностями:
1 кат = 1 моль S/с = 60 моль S/хв = 60×106 мкмоль/хв = 6×107 МО,
1 МО = 1 мкмоль/хв = 1/60 мкмоль/с = 1/60 мк кат = 16,67 нкат.
У медичній та фармацевтичній практиці для оцінки активності ферментів часто використовують міжнародні одиниці активності – МО. Для оцінки кількості молекул ферменту серед інших білків даної тканини визначають питому активність (пит. ак.) ферменту, що чисельно дорівнює кількості одиниць активності ферменту (nМО) у зразку тканини на масу [мг] білка в цій тканині:

За питомою активністю оцінюють очищення ферменту: чим менше сторонніх білків, тим вища питома активність.
Залежність швидкості ферментативної реакції
від температури середовища
Підвищення температури до певної межі впливає на швидкість ферментативної реакції, подібно до впливу температури на будь-яку хімічну реакцію. З підвищенням температури прискорюється рух молекул, що призводить до підвищення ймовірності взаємодії реагуючих речовин. Крім того, температура може підвищувати енергію реагуючих молекул, що також призводить до прискорення реакції. Але швидкість хімічної реакції, що каталізується ферментами, має свій температурний оптимум, перевищення якого супроводжується зниженням ферментативної активності, що виникає через термічну денатурацію білкової молекули (рис. 17).

| Рис. 17. | Залежність швидкості ферментативної реакції (V) від температури |
Для більшості ферментів людини оптимальною є температура 37–38 ºС. Але в природі існують і термостабільні ферменти. Наприклад, Taq-полімераза, виділена з мікроорганізмів, що живуть у гарячих джерелах, не інактивується при підвищенні температури до 95 ºС. Цей фермент використовують у науково-практичній медицині для молекулярної діагностики захворювань з використанням методу полімеразної ланцюгової реакції (ПЛР).
Залежність швидкості ферментативної реакції
від рН середовища
Активність ферментів залежить від рН розчину, в якому відбувається ферментативна реакція. Для кожного ферменту існує значення рН при якому спостерігається його максимальна активність. Відхилення від оптимального значення рН призводить до зниження ферментативної активності.
Вплив рН на активність ферментів пов’язаний з іонізацією функціональних груп амінокислотних залишків даного білка, які забезпечують оптимальну конформацію активного центру ферменту. Внаслідок відхилення рН від оптимальних значень відбувається зміна іонізації функціональних груп молекули білка. Наприклад, внаслідок закислення середовища відбувається протонування вільних аміногруп (NH3+), а внаслідок залуження відбувається відщеплення протону від карбоксильних груп (СОО–). Це призводить до зміни конформації молекули ферменту і конформації активного центру; отже, порушується приєднання субстрату, кофакторів і коферментів до активного центру. Крім того, рН середовища може впливати на ступінь іонізації або просторову організацію субстрату, що також впливає на спорідненість субстрату до активного центру. При значному відхиленні від оптимального значення рН може відбуватися денатурація білкової молекули з повною втратою ферментативної активності.
Оптимум значення рН у різних ферментів є різним (рис. 18). Ферменти, що працюють у кислих умовах середовища (наприклад, пепсин у шлунку або лізосомальні ферменти), еволюційне набувають конформації, що забезпечує роботу ферменту при кислих значеннях рН. Але більша частина ферментів організму людини має оптимум рН, близький до нейтрального, що співпадає з фізіологічним значенням рН (табл. 1).
Таблиця 1
Оптимальні значення рН для деяких ферментів
| Фермент | Оптимальне значення рН |
| Пепсин Піруваткарбоксилаза Каталаза Фумараза Уреаза Карбоксипептидаза Трипсин Аргіназа | 1,5-2 4,8 6,8-7 6,5 6,8-7,2 7,5 6,5-7,5 9,5-9,9 |

| Рис. 18. | Залежність швидкості ферментативної реакції (V) від рН середовища |
Залежність швидкості ферментативної реакції
від кількості субстрату
Якщо концентрацію ферментів залишити постійною, змінюючи тільки кількість субстрату, то графік швидкості ферментативної реакції описують гіперболою (рис. 19).

| Рис. 19. | Залежність швидкості реакції (V) від концентрації субстрату (S): Vmax – максимальна швидкість реакції за даної концентрації ферменту в оптимальних умовах проведення реакції; Km – константа Міхаеліса. |
Під час збільшення кількості субстрату початкова швидкість збільшується. Коли фермент стає повністю насиченим субстратом, тобто відбувається максимально можливе за даної концентрації ферменту формування ферментсубстратного комплексу, спостерігають найбільшу швидкість утворення продукту. Подальше підвищення концентрації субстрату не призводить до збільшення утворення продукту, тобто швидкість реакції не збільшується. Цей стан відповідає максимальній швидкості реакції Vmax.
Таким чином, концентрація ферменту – лімітуючий фактор в утворенні продукту. Це спостереження стало основою ферментативної кінетики, розробленої вченими Л. Міхаелісом і М. Ментен у 1913 р.
Ферментний процес можна виразити наступним рівнянням:

де k1 – константа швидкості утворення ферментсубстратного комплексу; k–1 – константа швидкості зворотної реакції, розпаду ферментсубстратного комплексу; k2 – константа швидкості утворення продукту реакції.
Наступне співвідношення констант швидкостей (k–1 + k2)/k1 називають константою Міхаеліса і позначають Km.
Швидкість реакції пропорційна концентрації ферментсубстратного комплексу ES, а швидкість утворення ES залежить від концентрації субстрату та концентрації вільного ферменту. На концентрацію ES впливає швидкість формування і розпаду ES.
Найбільша швидкість реакції спостерігається в тому випадку, коли всі молекули ферменту знаходяться в комплексі з субстратом, тобто ферментсубстратному комплексі ES, тобто [E] = [ES].
Залежність швидкості ферментативної реакції від концентрації субстрату виражається наступним рівнянням (математичне виведення цієї формули можна знайти у посібниках з ферментативної кінетики):
 .
.
Це рівняння отримало назву рівняння Міхаеліса-Ментен.
У випадку, коли швидкість реакції дорівнює половині максимальної, Km = [S] (рис. 19). Таким чином, константа Міхаеліса чисельно дорівнює концентрації субстрату, за якої досягається половина максимальної швидкості.
Рівняння Міхаеліса-Ментен – основне рівняння ферментативної кінетики, що описує залежність швидкості ферментативної реакції від концентрації субстрату.
Якщо концентрація субстрату значно більша Km (S>> Km), то збільшення концентрації субстрату на величину Km практично не впливає на суму (Km + S) і її можна вважати рівною концентрації субстрату. Відповідно, швидкість реакції стає рівною максимальній швидкості: V = Vmax. За цих умов реакція має нульовий порядок, тобто не залежить від концентрації субстрату. Можна зробити висновок, що Vmax – величина постійна для даної концентрації ферменту й не залежить від концентрації субстрату.
Якщо концентрація субстрату значно менша за Km (S<< Km), то сума (Km + S) приблизно дорівнює Km, відповідно, V = Vmax[S]/ Km, тобто в даному випадку швидкість реакції прямо пропорційна концентрації субстрату (реакція має перший порядок).
Vmax і Km – кінетичні характеристики ефективності дії ферменту.
Vmax – є характеристикою каталітичної активності ферменту й має розмірність швидкості ферментативної реакції моль/л, тобто визначає максимальну можливість утворення продукту за даної концентрації ферменту і за умов надлишку субстрату.
Km характеризує спорідненість даного ферменту до даного субстрату й є величиною постійною, яка не залежить від концентрації ферменту. Чим менша Km, тим більшою є спорідненість ферменту до даного субстрату, тим вища початкова швидкість реакції і навпаки, чим більша Km, тим менша початкова швидкість реакції, тим менша спорідненість ферменту до субстрату.
На рис. 20 представлена залежність швидкості двох ферментативних реакцій (1 і 2) від концентрації субстрату. Константа Міхаеліса першого ферменту менша константи Міхаеліса другого ферменту (Km1 < Km2). Отже, спорідненість першого ферменту до субстрату є вищою, ніж у другого ферменту, і початкова швидкість реакції, що каталізується першим ферментом, вища в порівнянні з другим ферментом.

| Рис. 20. | Вплив різних концентрацій субстрату на швидкість реакції, що каталізується ферментами 1 і 2 |