 |
Інгібування ферментативної активності
Дата добавления: 2014-07-26 | Просмотров: 1836
|
|
Під терміном «інгібування ферментативної активності» розуміють зниження каталітичної активності в присутності певних речовин – інгібіторів. До інгібіторів відносять речовини, що викликають зниження активності ферменту. Потрібно зазначити, що всі денатуруючі агенти також викликають зменшення швидкості будь-якої ферментативної реакції, внаслідок неспецифічної денатурації білкової молекули, тому денатуруючі агенти до інгібіторів не відносять.
Інгібітори викликають велику зацікавленість під час вивчення механізмів ферментативного каталізу, допомагають встановити роль окремих ферментів у метаболічних шляхах організму. В основі дії багатьох лікарських препаратів і отрут лежить інгібування активності ферментів, тому знання механізмів цього процесу є дуже важливим для молекулярної фармакології і токсикології.
Інгібітори здатні взаємодіяти з ферментами з різним ступенем міцності. На основі цього розрізняють зворотне і незворотне інгібування. За механізмом дії інгібітори поділяють на конкурентні й неконкурентні.
Зворотне інгібування
Зворотні інгібітори зв’язуються з ферментами слабкими нековалентними зв’язками і за певних умов легко відокремлюються від ферменту.
До конкурентного інгібування відносять зворотне зниження швидкості ферментативної реакції, викликане інгібітором, що зв’язався з активним центром ферменту й перешкоджає утворенню ферментсубстратного комплексу. Такий тип інгібування спостерігають, коли інгібітор є структурним аналогом субстрату. В результаті даного типу інгібування виникає конкуренція молекул субстрату та інгібітора за місце зв’язування в активному центрі ферменту. В такому випадку з ферментом взаємодіє або субстрат, або інгібітор, утворюючи комплекси фермент – субстрат (ES) або фермент – інгібітор (ЕІ). Внаслідок формування комплексу ферменту та інгібітора продукт реакції не утворюється (рис. 21).
Для конкурентного типу інгібування справедливі наступні рівняння:
E + S ↔ ES → E + P
E + I ↔ EI
Класичний приклад конкурентного інгібування – інгібування сукцинат-дегідрогеназної реакції малоновою кислотою (рис. 22). Малонова кислота – структурний аналог сукцинату (наявність двох карбоксильних груп) і може також взаємодіяти з активним центром сукцинатдегідрогенази. Але відщеплення двох атомів водню від малонової кислоти є неможливим; отже, швидкість реакції знижується.

| Рис. 21. | Схема конкурентного інгібування активності ферменту |
Конкурентні інгібітори зменшують швидкість хімічної реакції. Конкурентний інгібітор підвищує Km для даного субстрату (зменшує спорідненість субстрату до ферменту). Це означає, що в присутності конкурентного інгібітора необхідна велика концентрація субстрату для досягнення 1/2Vmax.
Збільшення співвідношення концентрації субстрату та інгібітора знижує ефективність інгібування. При значно вищих концентраціях субстрату інгібування повністю зникає, тому що активні центри усіх молекул ферменту будуть знаходитися переважно в комплексі з субстратом.
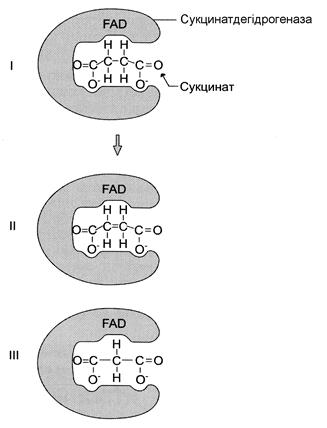
| Рис. 22. | Приклад конкурентного інгібування сукцинатдегідрогенази малоновою кислотою: І – сукцинат зв’язується з активним центром ферменту сукцинатдегідрогенази; ІІ – під час ферментативної реакції відбувається відщеплення двох атомів водню від сукцинату й приєднання їх до коферменту FAD. У результаті утворюється фурамат, який звільняється з активного центру сукцинатдегідрогенази; ІІІ – малонова кислота – структурний аналог сукцинату, вона також зв’язується з активним центром сукцинатдегідрогенази. При цьому хімічної реакції не відбувається. |
Багато лікарських препаратів чинять свій терапевтичний вплив за механізмом конкурентного інгібування. Наприклад, четвертинні амонієві основи інгібують ацетилхолінестеразу, що каталізує реакцію гідролізу ацетилхоліну на холін і оцтову кислоту:

Внаслідок додавання інгібіторів активність ацетилхолінестерази зменшується, концентрація ацетилхоліну (субстрату) збільшується, що супроводжується посиленням проведення нервового імпульсу. Інгібітори холінестерази використовують у лікуванні м’язової дистрофії. Ефективні антихолінестеразні препарати – прозерин, ендрофоній та ін. (рис. 23).

| Рис. 23. | Схема активного центру ацетилхолінестерази: А – приєднання ацетилхоліну в активному центрі ферменту. Стрілкою вказане місце гідролізу ефірного зв’язку в молекулі ацетилхоліну; Б – приєднання конкурентного інгібітора – прозерину в активному центрі ферменту. Вказане місце гідролізу прозерину, але реакція йде набагато повільніше, ніж з ацетилхоліном; В – приєднання конкурентного інгібітора ендорфонію до активного центру ферменту. Ендорфоній зв’язується в активному центрі ацетилхолінестерази, перешкоджаючи приєднанню ацетилхоліну |
В якості інгібіторів ферментів за конкурентним механізмом у медичній практиці використовують речовини, що називаються антиметаболітами. Ці сполуки, будучи структурними аналогами природних субстратів, викликають конкурентне інгібування ферментів з одного боку і, з іншого, можуть використовуватися цими ж ферментами в якості псевдосубстратів, що призводить до синтезу аномальних продуктів. Аномальні продукти не володіють функціональною активністю; в результаті спостерігається зниження швидкості певних метаболічних шляхів.
В якості лікарських препаратів використовують наступні антиметаболіти: сульфаніламідні препарати (аналоги параамінобензойної кислоти), що застосовується для лікування інфекційних хвороб, аналоги нуклеотидів для лікування онкологічних захворювань.
Неконкурентним називають таке інгібування ферментативної реакції, при якому інгібітор взаємодіє з ферментом у ділянці, відмінній від активного центру (рис. 24). Неконкурентні інгібітори не є структурними аналогами субстратів.

| Рис. 24. | Схема неконкурентного інгібування активності ферменту |
Неконкурентний інгібітор може зв’язуватися або з ферментом, або з ферментсубстратним комплексом, утворюючи неактивний комплекс. Приєднання неконкурентного інгібітора викликає зміну конформації молекули таким чином, що порушується взаємодія субстрату з активним центром ферменту, що призводить до зниження швидкості ферментативної реакції.
Кінетична залежність неконкурентного інгібування представлена на рис. 25. Цей тип інгібування характеризується зниженням Vmax ферментативної реакції та зменшенням спорідненості субстрату до ферменту, тобто збільшенням Km.

| Рис. 25. | Вплив неконкурентного інгібітора на швидкість ферментативної реакції в залежності від концентрації субстрату: Vmax – максимальна швидкість реакції за відсутності інгібітора; 'Vmax – максимальна швидкість реакції в присутності інгібітора; Km – константа Міхаеліса за відсутності інгібітора; 'Km – константа Міхаеліса в присутності інгібітора. |
Незворотне інгібування
Незворотне інгібування спостерігають у випадку утворення ковалентних стабільних зв’язків між молекулою інгібітора й ферменту. Найчастіше модифікації зазнає активний центр ферменту. В результаті фермент не може виконувати каталітичну функцію.
До незворотних інгібіторів належать іони важких металів, наприклад ртуті (Hg2+), срібла (Ag2+) і миш’яку (As3+), які в маленьких концентраціях блокують сульфгідрильні групи активного центру. Субстрат при цьому не може піддаватися хімічному перетворенню (рис. 26). За наявності реактиваторів ферментативна функція відновлюється. У великих концентраціях іони важких металів викликають денатурацію білкової молекули ферменту, тобто призводять до повної інактивації ферменту.

| Рис. 26. | Механізм дії йонів ртуті як необоротного інгібітора Йони ртуті в малих концентраціях блокують сульфгідрильні групи активного центру, що призводить до зниження швидкості ферментативної реакції. |
Специфічні і неспецифічні інгібітори. Використання незворотних інгібіторів викликає великий інтерес для з’ясування механізму дії ферментів. З цією метою використовують речовини, що блокують певні групи активного центру ферменту. Такі інгібітори називають специфічними. Ряд сполук легко вступає в реакції з певними хімічними групами. Якщо ці групи приймають участь у каталізі, то відбувається інактивація ферменту.
Роль гідроксильних груп серину в механізмі каталізу досліджують за допомогою фторфосфатів, наприклад диізопропілфторфосфату. Диізопропіл-фторфосфат (ДФФ) специфічно реагує лише з одним з багатьох залишків серину в активному центрі ферменту. Залишок Сер, що здатний реагувати з ДФФ, має ідентичне або дуже схоже амінокислотне оточення (табл. 2). Висока реакційна здатність цього залишку в порівнянні з іншими залишками Сер обумовлена амінокислотними залишками, що також входять до активного центру ферменту.
Таблиця 2
Дослідження послідовності амінокислотних залишків
навколо реакційноздатного залишку серину, що взаємодіє з ДФФ
| Фермент | Функція ферментів (підклас ферментів) | Амінокислотні залишки, що знаходяться в оточенні реакційноздатного серину в активному центрі |
| Хімотрипсин Трипсин Тромбін Еластаза | Протеолітичні ферменти | Асп Сер Глу Асп Сер Глу Асп Сер Глу Асп Сер Глу |
| Холінестераза Лужна фосфатаза | Естерази (гідроліз ефірного зв’язку | Глу Сер Ала Глу Сер Ала |
ДФФ належить до специфічних незворотних інгібіторів «серинових» ферментів, тому що він утворює ковалентний зв’язок із гідроксильною групою серину, який знаходиться в активному центрі й відіграє ключову роль у процесі каталізу (рис. 27).

| Рис. 27. | Інгібування активності хімотрипсину за допомогою диізопропілфторфосфату. |
Монойодоцтова кислота, п-хлормеркурібензоат легко вступають в реакції з SH-групами залишків цистеїну білків (рис. 28). Ці інгібітори не належать до специфічних, тому що вони реагують з будь-якими вільними SH-групами білків і називаються неспецифічними інгібіторами. Якщо SH-групи приймають участь безпосередньо в каталізі, то за допомогою цих інгібіторів можливим є визначення ролі SH-груп ферменту в каталізі.

| Рис. 28. | Інгібування активності ферментів внаслідок ковалентної модифікації залишків цистеїну |
Приклад лікарського препарату, дія якого заснована на необоротному інгібуванні ферментів, – широко використовуваний препарат аспірин. Протизапальний нестероїдний препарат аспірин забезпечує фармакологічну дію за рахунок інгібування ферменту циклооксигенази, що каталізує реакцію утворення простагландинів з арахідонової кислоти. У результаті хімічної реакції ацетильний залишок аспірину приєднується до вільної кінцевої ОН-групи серину циклооксигенази:
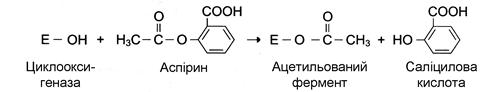
Це викликає зниження утворення продуктів реакції простагландинів, які володіють широким спектром біологічних функцій, зокрема є медіаторами запалення.