 |
Використання ферментів у медицині
Дата добавления: 2014-07-26 | Просмотров: 2009
|
|
Ферментативні препарати широко застосовують у медицині. Ферменти в медичній практиці знаходять застосування в якості діагностичних (ензимодіагностика) і терапевтичних (ензмотерапія) речовин.
Крім того, ферменти використовують в якості специфічних реактивів для визначення ряду сполук. Так, глюкозооксидазу використовують для кількісного визначення глюкози в сечі й крові. Фермент уреазу використовують для визначення вмісту кількості сечовини у крові й сечі. За допомогою різноманітних дегідрогеназ виявляють відповідні субстрати, наприклад піруват, лактат, етиловий спирт тощо.
Ензимодіагностика
Ензимодіагностика полягає у постановці діагнозу захворювання (або синдрому) на базі визначення активності ферментів у біологічних рідинах людини. Принципи ензимодіагностики засновані на наступних принципах:
· внаслідок пошкодження клітин у крові або інших біологічних рідинах (наприклад, у сечі) збільшується концентрація внутрішньоклітинних ферментів;
· кількість вивільненого ферменту є достатньою для його виявлення;
· активність ферментів у біологічних рідинах, які знаходять при пошкодженні клітин, є стабільною протягом досить довгого часу й відрізняється від нормальних значень;
· ряд ферментів має переважну або абсолютну локалізацію в певних органах (органоспецифічність);
· існують відмінності у внутрішньоклітинній організації ряду ферментів.
Причини, що призводять до збільшення кількості ферментів у крові. Ферменти плазми крові можна розділити на 2 групи. Перша, відносно невелика, група ферментів секретується в плазму крові певними органами. Наприклад, печінка синтезує неактивні попередники ферментів системи згортання крові. До другої відносять більшу групу ферментів, що вивільнюються з клітин під час їхнього нормального функціонування. Звичайно ці ферменти виконують функції в середині клітини і не мають фізіологічного значення в плазмі крові. У здорової людини активність цих ферментів в плазмі низька і достатньо постійна, це забезпечується постійним співвідношенням швидкостей вивільнення їх з клітин і швидкостей їх руйнування.
При багатьох захворюваннях відбувається руйнування клітин, і їх вміст, у тому числі і ферменти, виходять у кров. До причин, що викликають вивільнення внутрішньоклітинного вмісту в кров, відносять порушення проникності мембран клітин (при запальних процесах) або порушення цілісності клітин (при некрозі). Визначення в крові активності ряду ферментів у біохімічних лабораторіях використовується для діагностики захворювань серця, печінки, скелетної мускулатури і інших тканин. Рівень активності ферментів у плазмі корелює зі ступенем пошкодження клітин.
Для ензимодіагностики мають велике значення знання про субклітинну локалізацію ферментів. Так, поява в плазмі крові ферментів, що мають лише цитозольну локалізацію, свідчить про запальний процес; при знаходженні мітохондріальних або ядерних ферментів можна говорити про більш глибоке пошкодження клітини, наприклад про некроз.
Проте збільшення концентрації ферментів не завжди пов'язане з пошкодженням тканини. При надлишковій клітинній проліферації, наприклад, при онкопроліферативних процесах, при збільшенні швидкості синтезу деяких ферментів у клітинах або при порушеному кліренсі (здатність виводитися нирками) спостерігається збільшення концентрації в крові певних ферментів. Нормальні значення активності ферментів у крові дітей і вагітних жінок відрізняються від показників, характерних для дорослих здорових людей.
Ізоферменти. Ферменти, що каталізують одну й ту ж саму хімічну реакцію, але які відрізняються первинною структурою білка, називають ізоферментами, або ізоензимами. Вони каталізують один і той же тип реакцій з принципово однаковим механізмом, але відрізняються один від іншого кінетичними параметрами, умовами активації, особливостями зв'язку апоферменту та коферменту.
Природа появи ізоферментів різноманітна, але найчастіше обумовлена відмінностями в структурі генів, що кодують ці ізоферменти. Відповідно, ізоферменти відрізняються за первинною структурою білкової молекули, і відповідно, за фізико-хімічними властивостями. На відмінностях у фізико-хімічних властивостях засновано методи визначення ізоферментів.
За своєю структурою ізоферменти в основному є олігомерними білками. Причому та чи інша тканина переважно синтезує визначені види протомерів. У результаті визначеної комбінації цих протомерів формуються ферменти з різноманітною структурою – ізомерні форми. Виявлення певних ізомерних форм ферментів дозволяє використовувати їх для діагностики захворювань.
Ізоформи лактатдегідрогенази. Фермент лактатдегідрогеназа (ЛДГ) каталізує оборотну реакцію окислення лактату (молочної кислоти) до пірувату (піровиноградної кислоти):

Лактатдегідрогеназа – олігомерний білок із молекулярною масою 134 000 Д, що складається з 4 субодиниць 2 типів: М (від англ. muscle – м’яз) і Н (від англ. heart – серце). Комбінація цих субодиниць лежить в основі формування 5 ізоформ лактатдегідрогенази (рис. 35, А). ЛДГ1 та ЛДГ2 найбільш активні в серцевому м’язі й нирках, ЛДГ4 і ЛДГ5 – у скелетних м’язах і печінці. В інших тканинах є різні форми цього ферменту.
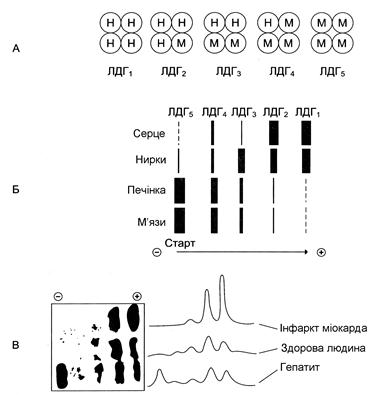
| Рис. 35. | Ізоформи лактатдегідрогенази: А – будова різних ізоформ ЛДГ; Б – розподіл на електрофореграмі та відносні кількості ізоформ ЛДГ у різних органах; В – вміст ізоформ ЛДГ у плазмі крові в нормі й при патології (електрофореграми – зліва, фотометричне сканування – справа). |
Ізоформи ЛДГ відрізняються електрофоретичною рухливістю, що дозволяє встановлювати тканинну приналежність ізоформ ЛДГ(рис. 35, Б).
Виникнення внаслідок еволюції різних форм ЛДГ обумовлене особливостями окисного метаболізму тканин. Ізоферменти ЛДГ4 та ЛДГ5 (м-типи ЛДГ) працюють ефективно в анаеробних умовах, ЛДГ1 та ЛДГ2 (Н-типи) – в аеробних, коли піруват швидко окислюється до СО2 і Н2О, а не відновлюється до молочної кислоти.
Під час ряду захворювань досліджують активність ЛДГ у плазмі крові. В нормі активність ЛДГ складає 170-520 ОД/л. Підвищення активності спостерігають при гострих ураженнях серця, печінки, нирок, а також при мегалобластичних і гемолітичних анеміях. Але це вказує на пошкодження лише одної з перерахованих тканин.
Для формулювання діагнозу необхідне дослідження ізоформ ЛДГ у плазмі крові методом електрофорезу. На рис. 35, В наведені електрофореграми плазми крові здорової людини, хворого на інфаркт міокарду й хворого на гепатит. Виявлення в плазмі крові тканиноспецифічних ізоформ ЛДГ використовують в якості діагностичного тесту на пошкодження даної тканини.
Ізоформи креатинкінази. Креатинкіназа (КК) каталізує реакцію утворення креатинфосфату:

Молекула КК – димер, що складається з субодиниць двох типів: М (від англ. muscle – м’яз) і В (від англ. brain – мозок). Із цих субодиниць утворюються 3 ізоферменти – ВВ, МВ, ММ. Ізофермент ВВ знаходиться переважно в головному мозку, ММ – у скелетних м’язах і МВ – у серцевому м’язі. Ізоформи КК мають різну електрофоретичну рухливість (рис. 36).

| Рис. 36. | Структура й електрофоретична рухливість різних ізоформ креатинкінази. |
Активність КК у нормі не повинна перевищувати 90 МО/л. Визначення активності КК у плазмі крові має діагностичне значення під час інфаркту міокарда (відбувається підвищення рівня МВ-ізоформи). Кількість ізоформи ММ може підвищуватись внаслідок травм і пошкоджень скелетних м’язів. Ізоформа ВВ не може проникати через гемоенцефалічний бар’єр, тому в крові практично не визначається навіть під час інсульту й діагностичного значення не має.
Ензимологія при інфаркті міокарда. Приблизно 30% хворих на інфаркт міокарда мають атипову клінічну картину цього захворювання. Тому необхідно проводити додаткові дослідження для підтвердження пошкодження серцевого м’язу.
Під час інфаркту міокарда спостерігають достовірні зміни в крові активностей ферментів КК, ЛДГ і аспартатамінотрансферази (АСТ), які залежать від часу, що пройшов від початку розвитку інфаркту й від зони тканинного пошкодження. Топову криву зміни активності цих ферментів можна побачити на рис. 37. Після закупорювання (оклюзії) коронарної судини в крові спочатку відмічають підвищення активності КК ізоформи МВ, але фермент швидко видаляється з кровотоку. Виявлення підвищеної активності КК у плазмі крові – основний ензимодіагностичний критерій інфаркту міокарда. Якщо в пацієнта із загрудинним болем не знайдено зміни в активності КК, діагноз інфаркт міокарда є малоймовірним.

| Рис. 37. | Зміна активності ферментів у плазмі крові під час інфаркту міокарда |
Додатковим підтвердженням діагнозу інфаркт міокарда є виявлення активності ферментів АСТ і ЛДГ у крові хворих. Динаміка змін цих активностей також зображена на рис. 37. Активність АСТ у нормі складає 5-40 МО/л. Під час інфаркту міокарда активність АСТ підвищується через 4 - 6 год; максимум активності спостерігають протягом 2 - 3 днів. Рівень ЛДГ також збільшується в плазмі крові через декілька годин після закупорювання кровоносної судини; максимум активності спостерігають на 3 - 4 день, потім настає поступова нормалізація активності. Рівень підвищення активності ЛДГ корелює з розмірами пошкодження серцевого м’язу.
Використання ферментів у якості лікарських препаратів
Використання ферментів у якості терапевтичних засобів має багато обмежень внаслідок їхньої високої імуногенності. Не дивлячись на це, ензимотерапію активно розвивають у наступних напрямках:
- замісникова терапія – використання ферментів у разі їх нестачі;
- елементи комплексної терапії – використання ферментів у поєднанні з іншою терапією.
Замісникова ензимотерапія є ефективною при шлунково-кишкових захворюваннях, пов’язаних із недостатньою секрецією травних соків. Наприклад, пепсин використовують під час ахілії, гіпо- і анацидних гастритів. Дефіцит панкреатичних ферментів також у значній мірі може компенсуватися вживанням препаратів, що містять основні ферменти підшлункової залози (фестал, ензистал, мезим-форте та ін.).
В якості додаткових терапевтичних засобів ферменти використовують під час ряду захворювань. Протеолітичні ферменти (трипсин, хімотрипсин) використовують для місцевого впливу при обробці гнійних ран із метою розщеплення білків загиблих клітин, для видалення згустків крові або в’язких секретів під час запальних захворювань дихальних шляхів. Ферментні препарати рибонуклеазу і дезоксирибонуклеазу використовують в якості противірусних препаратів, під час лікування аденовірусних кон'юнктивітів, герпетичних кератитів.
Ферментні препарати почали широко використовувати при тромбозах і тромбоемболіях. Із цією метою використовують препарати фібринолізину, стрептоліази, стрептодекази, урокінази.
Фермент гіалуронідазу (лідазу), що каталізує розщеплення гіалуронової кислоти, використовують підшкірно і внутрішньом'язово для розсмоктування контактур рубців після опіків і операцій (гіалуронова кислота утворює зшивки у сполучній тканині).
Ферментні препарати використовують при онкологічних захворюваннях. Аспарагіназа, що каталізує реакцію катаболізму аспарагіну, знайшла застосування для лікування лейкозів:

Передумовою антилейкімічної дії аспарагінази слугувало виявлення в лейкозних клітинах дефектного ферменту аспарагінсинтетази, що каталізує реакцію синтезу аспарагіну:

Лейкозні клітини не можуть синтезувати аспарагін і отримують його з плазми крові. Якщо наявний у плазмі крові аспарагін руйнувати введенням аспарагінази, то в лейкозних клітинах починається дефіцит аспарагіну й у результаті – порушення метаболізму клітини.
Контрольні запитання:
1. Дайте визначення активного центра ферменту.
2. Які види специфічності ферментів Ви знаєте ?
3. Що відрізняє хімічні каталізатори реакцій від біологічних ?
4. Якими методами можна визначити кінетичні параметри ферментів ?
5. Які типи інгібування ферментативної активності Ви знаєте? У чому полягає механізм інгібуючої дії ?