 |
ТЕОРИЯ РАСТВОРОВ
Дата добавления: 2014-05-20 | Просмотров: 1605
|
|
Большинство химических реакций протекает в растворах.
Растворимость–это свойство вещества растворяться в воде или другом растворителе.
Растворимое вещество образует с растворителем гомогенные смеси с дисперсным распределением компонентов. Растворимость определяется физическим и химическим сродством молекул растворителя и растворяемого вещества, соотношением энергий взаимодействия компонентов раствора. В частности, вещества, состоящие из полярных молекул, и вещества с ионным типом связи хорошо растворимы в полярных растворителях (воде, этаноле, жидком аммиаке), а неполярные вещества хорошо растворимы в неполярных растворителях (бензоле, сероуглероде). Вода является хорошим растворителем полярных соединений не только потому, что их молекулы обладают значительной полярностью, но еще и потому, что при растворении сохраняется природа связей, существовавших в исходных компонентах.
Растворимость твердых веществ
С позиции молекулярно-кинетической теории растворение твердого вещества в жидкости протекает следующим образом. При внесении в воду, например, поваренной соли, ионы Na+ и Cl-, находящиеся на поверхности кристалла NaCl, в результате колебательного движения могут отрываться и переходить в растворитель. Этот процесс распространяется на следующие слои частиц, которые обнажаются в кристалле после удаления поверхностного слоя. Так постепенно частицы, образующие кристалл (ионы или молекулы), переходят в раствор. На рисунке 7.1 представлена схема разрушения ионной кристаллической решетки NaCl при растворении в воде, состоящей из полярных молекул. Частицы, перешедшие в раствор, вследствие диффузии распределяются по всему объему растворителя.
|
| |
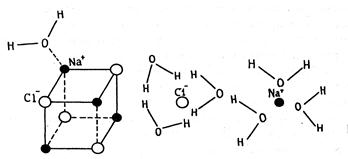
Рисунок 7.1 - Схема растворения кристаллической решетки NaCl в воде
По растворимости в воде вещества делят на три группы: хорошо растворимые, мало растворимые, практически нерастворимые. Следует отметить, что абсолютно нерастворимых веществ нет.
Растворение большинства кристаллических веществ в воде идет с поглощением теплоты (DН > 0, эндотермический эффект), что связано с затратой энергии на разрушение кристаллической решетки твердого тела. Растворимость твердых веществ в воде колеблется в широких пределах. В подавляющем большинстве случаев при увеличении температуры она увеличивается. Однако наблюдаются исключения из этого правила. Например, гипс CaSO4×2H2O при нагревании теряет до 75% кристаллизационной воды и растворимость его уменьшается. При температуре около 200°С полуводный гипс практически не растворяется в воде. Этим объясняется его осаждениие при высоких температурах на стенках теплообменников в виде накипи. Уменьшают свою растворимость с повышением температуры оксид кальция СаО, карбонат лития Li2CO3 и др.
Процесс растворения твердого тела можно ускорить его измельчением и тщательным перемешиванием с растворителем. Этим достигается большая площадь контакта растворяемого вещества с растворителем.
Зависимость параметров растворимости твердых веществ от температуры графически выражают кривой растворимости. Кривые растворимости позволяют установить, изменяется ли состав соединений, образуемых растворенным веществом с растворителем. Если качественный состав вещества при изменении температуры не изменяется, то кривая растворимости идет плавно. Перегибы на кривой свидетельствуют об изменении химического состава имеющихся в растворе частиц.
Раствор, в котором вещество при данной температуре больше не растворяется, т.е. раствор, находящийся в равновесии с растворяемым веществом, называют насыщенным.Раствор, в котором концентрация растворенного вещества меньше, чем в насыщенном растворе, и в котором при данных условиях можно растворить еще некоторое его количество получил название ненасыщенного. Раствор, в котором растворённого вещества содержится больше, чем в насыщенном растворе при тех же условиях (температура, давление) называют перенасыщенным. Пересыщенные растворы представляют собой неустойчивые неравновесные системы. В процессе их самопроизводного перехода в равновесное состояние выделяется избыток растворенного вещества, и раствор становится насыщенным. Иногда используют понятия разбавленный и концентрированный растворы, которые качественно характеризуют соотношение количеств растворенного вещества и растворителя в растворе. Разбавленные растворы – это растворы с небольшим, концентрированныерастворы – с большим содержанием растворенного вещества.
Мерой растворимости твердых веществ служит величина, называемая коэффициентом растворимости, – масса вещества, содержащаяся в 100 г растворителя для получения насыщенного раствора при данной температуре. По величине коэффициента растворимости твердые вещества делят на хорошо растворимые (S >10 г), малорастворимые (10 г > S > 0,01 г) и практически нерастворимые (S < 0,01 г). Обычно при повышении температуры растворимость твердых веществ увеличивается, газов - уменьшается. Коэффициент растворимости определяется как отношение массы m1 вещества, образующего насыщенный раствор при данной температуре, к массе m2 растворителя: RS = m1/m2.
Величина растворимости (S) вещества соответствует максимальной массе вещества, которая может раствориться в 100 г растворителя. Растворимость зависит от природы растворяемого вещества и растворителя, наличия в растворе посторонних веществ, температуры, а в случае газообразного растворяемого вещества – от давления.