 |
Задание 1. Коагуляция гидрофобных коллоидов. Определение порога коагуляции и вычисление коагулирующей силы.
Дата добавления: 2014-09-29 | Просмотров: 1507
|
|
Коагуляцию гидрофобных золей осуществляют действием следующих растворов: КС1, K2SO4, СаС12 (все растворы 1 М).
Изучая коагулирующее действие указанных растворов, необходимо определить пороги коагуляции коллоидов этими электролитами. Чем меньше порог коагуляции, тем больше коагулирующая сила иона, вызвавшего коагуляцию данного коллоида (по правилу значности и валентности).
В пробирки, установленные в штативе (кроме двух), наливают по 1 мл испытуемого золя (по заданию преподавателя). Готовят контрольный раствор: в первую пробирку с 1 мл испытуемого золя добавляют 1мл дистиллированной воды. Пипеткой берут из колбы с 1 М раствором КС1 1 мл и добавляют в следую пробирку с гидрозолем. Сравнивая содержимое этой пробирки с контрольным раствором, убеждаются в том, что хлористый калий такой концентрации вызывает коагуляцию коллоида. Отмечают в таблице 23 наличие коагуляции знаком «+» и приступают к разбавлению раствора КС1.
Таблица 23
Результаты определения порога коагуляции гидрофобных золй.
| № п/п | концентрация электролита С, ммоль/л | номер испытуемого золя | ||
| КС1 | K2SO4 | СаС12 | ||
| и т.д. |
Возьмите две оставшиеся чистыми пробирки и опустите каждую из них по пипетке на 1 мл, предварительно помыв. В одну из этих пробирок налейте произвольное количество дистиллированной воды (она потребуется для разбавления электролита), во вторую - 1 мл 1 М КС1 и добавьте из пробирки с дистиллированной водой 1 мл. Размешайте содержимое пробирки 2 продуванием воздуха через пипетку и из образовавшихся 2 мл раствора КС1 отберите этой же пипеткой 1 мл раствора и перенесите его в пробирку с золем. Пипетку в золь не опускать, а сливать электролит по стенке пробирки! Осторожно размешайте содержимое пробирки и, если раствор помутнел (сравнить с контрольным раствором), отметьте в табл. наличие коагуляции знаком «+», в случае отсутствия ее - знаком «-». Дальнейшее разбавление электролита проводят аналогично. Так, разбавляя электролит и добавляя его по 1 мл в последующие пробирки с золем, найдите такую концентрацию электролита, при которой коагуляция уже не наблюдается. Концентрацию разбавленных растворов электролитов удобно выражать и записывать в табл. (графа С) в виде дроби в соответствующей степени, например:1)  ; 2)
; 2)  ; З)
; З) 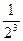 и т.д.
и т.д.
Как уже говорилось ранее, та минимальная концентрация электролита, при которой наблюдается коагуляция золя, называется порогом коагуляции данного электролита. Ее величину находят для каждого электролита и записывают в таблицу 24 (порог коагуляции для СаС12 и K2SO4 определяют так же, как и для КС1). По величине порогов коагуляции устанавливают ионы-коагуляторы. Затем вычисляют коагулирующую силу иона-коагулятора, условно принимая коагулирующую силу одновалентного иона равной единице. Коагулирующую силу двухвалентного иона (S) вычисляют по формуле: S =  .
.
Пример: если С1=  , а С2=
, а С2=  , то S=
, то S= 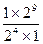 =25=32.
=25=32.
Таблица 24
Результаты расчета коагулирующей силы испытуемого золя.
| электролиты | испытуемый золь | ||
| ионы-коагуляторы | порог коагуляции | коагулирующая сила | |
| КС1 | |||
| СаС12 | |||
| K2SO4 |
Полученные данные показывают, что коагулирующая сила двухвалентного иона в десятки раз (в нашем случае в 32 раза) больше коагулирующей силы одновалентного иона.
На основании полученных данных определите знак заряда коллоидных частиц исследуемого золя и сделайте письменный вывод.
Задание 2. Коагуляция гидрофильных коллоидов действием дегидратирующих веществ.
Установление обратимости и необратимости коллоидов.
1.Налить в 2 пробирки по 2мл раствора сернистой сурьмы. В первую пробирку добавить 2 мл дистиллированной воды - этот раствор будет использоваться как контрольный. Во вторую пробирку из бюретки по каплям добавить насыщенный раствор сульфата аммония ДО ПОЯВЛЕНИЯ ХЛОПЬЕВ (сравнить с контрольным раствором). Отметить количество мл раствора сульфата аммония, вызвавшего коагуляцию и записать в таблицу 25. В эту же пробирку добавить 5 мл дистиллированной воды и убедиться в необратимости коагуляции гидрофобного золя.
2. Налить в 3 пробирки по 2 мл 0,5% раствора желатина. В первую пробирку добавить 5 мл дистиллированной воды - контрольный раствор.
Во вторую пробирку из бюретки приливать по 0,5 мл этилового спирта ДО ПОЯВЛЕНИЯ НЕБОЛЬШИХ ХЛОПЬЕВ ИЛИ ПОЯВЛЕНИЯ МУТИ (сравнить с контрольной пробиркой). Отметить количество прибавленного реактива, записав результат в таблицу 25. Затем в эту же пробирку прибавлять из бюретки дистиллированную воду по 0,5 мл ДО ИСЧЕЗНОВЕНИЯ ХЛОПЬЕВ (сравнить с контрольной пробиркой). Отметить количество прибавленной воды, записав результат в таблицу.
В третью пробирку с гидрозолем желатина из бюретки прибавлять по 0,5 мл насыщенного раствора сульфата аммония ДО ПОЯВЛЕНИЯ ХЛОПЬЕВ. Отметить количество прибавленного реактива, записав в тетрадь. Затем к содержимому пробирки прибавлять по 0,5 мл дистиллированной воды ДО ИСЧЕЗНОВЕНИЯ ХЛОПЬЕВ. Отметить количество прибавленной воды.
На основании опытов сделать вывод о коагуляции гидрофобных и гидрофильных золей и их обратимости.
Таблица 25 .
Результаты коагуляции гидрофильных и гидрофобных золей и определение их обратимости
| название золя | реактив | количество реактива (мл), пошедшее на коагуляцию | количество воды (мл), пошедшее на пепти-зацию | вывод об обратимости коллоидов | |
| гидрофильный коллоид -0,5% раствор желатина | С2Н5ОН (NH4)2SO4 | ||||
| гидрофобный коллоид - золь сернистой сурьмы | (NH4)2SO4 | ||||