 |
Класифікація та властивості ПАР.
Дата добавления: 2014-10-03 | Просмотров: 1647
|
|
Молекули ПАР складаються з довгого вуглеводневого ланцюга та полярної функціональної групи За здатністю до дисоціації ПАР поділяються на іоногенні та неіоногенні. В свою чергу іоногенні ПАР поділяються на аніонітні, катіонітні та амфолітні або амфотерні.
Аніонітні ПАР дисоціюють у воді з утворенням поверхнево-активного аніона. До них відносяться:
карбонові кислоти, сульфокислоти та їх солі: RCOOH; RCOOM,
RSO3M; RarSO3M; M=(Na, K, . . .)
Катіонітні ПАР дисоціюють з утворенням поверхнево активного катіона, наприклад солі амінів RNH3Cl; R2NH2Cl; R3NCl
Амфолітні ПАР можуть утворювати при дисоціації, поверхнево – активні іони різного знаку, в залежності від рН середовища.
До них відносяться амінокислоти RNH(CH2)nCOOH
Неіоногенні ПАР в розчинах не дисоціюють.. До неіоногенних ПАР відносяться спирти та похідні оксиду етилену.
ROH; R(OCH2CH2)nOH
За розчинністю ПАР поділяють на істино розчинні та колоїдні.
Істинно розчинні ПАР це дифільні органічні сполуки з невеликим вуглецевим радикалом, наприклад нижчі спирти, феноли, кислоти та їх солі. Ці речовини знаходяться в водних розчинах в молекулярно – дисперсійному стані до концентрації, що відповідає їх насиченому розчину. При подальшому збільшені концентрації система розділяється на дві окремі фази.
Колоїдні ПАР мають невелику розчинність у воді та здатні сильно зменшувати поверхневий натяг адсорбуючись на поверхні поділу фаз. При дуже малих концентраціях колоїдні ПАР утворюють істині розчини. Але при деякій концентрації, яку називають критична концентрація міцелоутворення (ККМ) ПАР починають утворювати агрегати молекул. Внаслідок цього загальна розчинність ПАР зростає, тоді як молекулярна розчинність залишається незмінною і дорівнює ККМ. Значення критичної концентрації міцелоутворення для більшості колоїдних ПАР знаходиться в межах 10-5 – 10-3 моль/л.
Важливою характеристикою молекул колоїдних ПАР, що має вирішальне значення для їх поверхневих і об’ємних властивостей, а значить, і для їх застосування, є співвідношення двох частин (груп) молекули - гідрофільної і гідрофобної (ліпофільної). Це співвідношення назвали гідрофільно-ліпофільний баланс (ГЛБ). Для розрахунку ГЛБ користуються запропонованими Гріффіном і розвиненою Девісом напівемпіричною системою ГЛБ, що дозволяє з енергетичних позицій кількісно оцінити і виразити у вигляді умовних групових чисел ступінь взаємодії з водою окремих груп, з яких складається молекула ПАР. Групові числа гідрофільних груп вважаються позитивними, а ліпофільних - негативними.
Система ГЛБ є до певної міри формальною, оскільки вона виходить зі стереометричного складу сполук і не враховує геометричних особливостей будови їх молекул, наприклад, ізомерії. Але вона дозволяє визначити область застосування ПАР.
9.2. Міцели ПАР.
В розчинах колоїдних ПАР з концентрацією вищою від ККМ молекули ПАР утворюють агрегати молекул – міцели. Їх структура залежить від полярності розчинника. В водних розчинах молекули ПАР утворюють агрегати в яких вуглецевий ланцюг знаходиться всередині, а функціональні групи повернуті до водної фази і утворюють полярний шар.
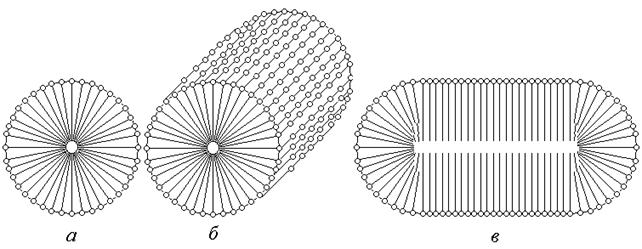
Рис. 72. Міцели ПАР.
При збільшенні концентрації вище від ККМ спочатку утворюються сферичні міцели - міцели Гартлі рис.72 (а), які при подальшому збільшенні концентрації перетворюються на дискові та циліндричні рис.72 (б). При подальшому збільшенні концентрації утворюються пластинчаті міцели рис.72 (в) – міцели Мак-Бена, що можуть утворювати рідкокристалічні структури або бішарові ліпідні мембрани.
Число агрегацій міцели, це кількість молекул з яких складається міцела. Воно складає як правило 20-100, але може сягати і 1000.
Визначення ККМ базується на тому, що при утворенні міцел відбувається зміна всіх властивостей розчину ПАР. Нефелометричним методом доведено, що утворення міцел призводить до різкого збільшення світлорозсіювання розчином ПАР, в наслідок того, що система стала гетерогенною. Також зазнають зміни осмотичний тиск, та електропровідність розчину ПАР.
Крім того ККМ можна визначити за зміною поверхневого натягу розчину ПАР при збільшенні її концентрації. Зі збільшенням вмісту ПАР поверхневий натяг спадає рис.73, досягаючи в точці, що відповідає ККМ свого найменшого, майже постійного значення.

Рис. 73. Визначення ККМ для колоїдних ПАР.
В неполярних розчинниках міцели ПАР утворюють зворотні міцели в яких функціональні групи знаходяться всередині, а вуглецевий ланцюг ззовні. Для таких міцел відсутня ККМ, а число агрегацій таких міцел дорівнює 30-40.