 |
Регуляція метаболічних процесів
Дата добавления: 2014-07-26 | Просмотров: 2314
|
|
Жива клітина – відкрита система, що постійно обмінюється із зовнішнім середовищем речовинами та енергією: до неї надходять поживні речовини, що піддаються перетворенням і використовуються в якості будівельного й енергетичного матеріалу, з клітини виводяться кінцеві продукти метаболізму. У багатоклітинному організмі клітина реагує не тільки на зміну оточуючого середовища, але і на функціональну активність сусідніх клітин. При цьому вона прагне зберегти незмінним свій внутрішній вміст. Цей стан називають стаціонарним або клітинним гомеостазом.
У клітині постійно відбувається велика кількість різноманітних хімічних реакцій, які формують метаболічні шляхи – послідовні перетворення одних сполук на інші. Метаболізм – сукупність усіх метаболічних шляхів, що відбуваються в клітинах організму.
Серед усіх метаболічних шляхів, що відбуваються в організмі, виділяють протилежно направлені процеси: катаболізм і анаболізм. Катаболізм – розклад складних речовин до простих з вивільненням енергії. Анаболізм – синтез із простих речовин більш складних. Метаболічні шляхи узгоджені між собою за місцем, часом та інтенсивністю протікання. Ця узгодженість протікання всіх процесів забезпечується складними і різноманітними механізмами регуляції.
Організація хімічних реакцій у метаболічні шляхи
Оптимальна активність ферментів, що каталізують реакції одного метаболічного шляху, досягається завдяки певній просторовій організації в клітині.
Просторова локалізація ферментів. Більшість ферментів має внутрішньоклітинну локалізацію й розміщені в організмі нерівномірно. Усі ферменти одного метаболічного шляху, як правило, знаходяться в одному компартменті клітини. Розділення метаболічних шляхів є особливо важливим для протилежно напрямлених катаболічних і анаболічних процесів. Наприклад, синтез жирних кислот відбувається в цитоплазмі, а їх розклад – у мітохондріях. Якби такого розділення не існувало, утворювалися б непотрібні з функціональної та енергетичної точки зору шляхи.
У метаболічних шляхах продукт першої ферментативної реакції слугує субстратом другої і т.д. до формування кінцевого продукту. Проміжні продукти метаболічного шляху можуть виходити із послідовності реакцій і використовуватися в інших метаболічних шляхах, тобто метаболічні шляхи пов’язані між собою проміжними продуктами.
У ряді випадків просторова організація ферментів є настільки сильно вираженою, що продукт реакції ні за яких умов не може бути виділеним із метаболічного шляху і обов’язково слугує субстратом наступної реакції. Така організація метаболічного шляху носить назву мультиферментного комплексу й виникає в результаті структурно-функціональної організації ферментів. Звичайно такі комплекси пов’язані з мембранами. В якості прикладів мультиферментних комплексів можна навести піруватдегідроге-назний комплекс, під дією якого відбувається окисне декарбоксилювання піровиноградної кислоти (пірувату), синтазу жирних кислот, що каталізує синтез пальмітинової кислоти тощо.
Структура метаболічних шляхів у клітині є дуже різноманітною (табл. 3). У випадку, коли субстрат у результаті сукупності ферментативних процесів перетворюється на один продукт, такий шлях носить назву лінійного метаболічного шляху. Часто зустрічаються розгалужені метаболічні шляхи, що призводять до синтезу різних кінцевих продуктів у залежності від потреб клітини. У процесі вивчення курсу біологічної хімії ви ознайомитеся з циклічними та спіральними метаболічними шляхами.
Таблиця 3
Типи метаболічних шляхів
| Схема | Назва | Приклад |

| Лінійний | Гліколіз |

| Розгалужений | Синтез нуклеотидів |

| Циклічний | Цикл трикарбонових кислот Синтез сечовини |

| Спіральний | β-окислення жирних кислот |
Ферментний склад різних клітин не є однаковим. Ферменти, що виконують функції життєзабезпечення клітини, знаходяться в усіх клітинах організму. У процесі диференціювання відбувається зміна ферментного складу клітин. Так, фермент аргіназа, що приймає участь у синтезі сечовини, знаходиться тільки в клітинах печінки, а кисла фосфатаза, що приймає участь у гідролізі моноефірів ортофосфорної кислоти, – у клітинах простати. Це так звані органоспецифічні ферменти.
Якщо говорити про вузькоспеціалізовані клітини, то ферментів, що виконують функції в цих клітинах, знаходиться більше, ніж в інших клітинах. Наприклад, у клітинах серцевого м’язу міститься підвищена кількість ферментів креатинкінази й аспартатамінотрансферази, у клітинах печінки – аланінамінотрансферази й аспартатамінотрансферази, в остеобластах – лужної фосфатази і т.д.
Компартменталізація. Клітина – складнофункціональна система, що регулює своє життєзабезпечення. Різноманітність функцій клітини забезпечується просторовою та часовою (у першу чергу, в залежності від ритму харчування) регуляцією певних метаболічних шляхів. Просторова регуляція пов’язана з чіткою локалізацією певних ферментів у різних органелах. Так, в ядрі знаходяться ферменти, пов’язані з синтезом молекул ДНК і РНК, в цитоплазмі – ферменти гліколізу, у лізосомах – гідролітичні ферменти, у матриксі мітохондрій – ферменти ЦТК, у внутрішній мембрані мітохондрій – ферменти ланцюга перенесення електронів і т.д. (рис. 29). Така субклітинна локалізація ферментів сприяє впорядкованості біохімічних процесів і збільшує швидкість обміну речовин.

| Рис. 29. | Внутрішньоклітинна локалізація ферментів |
Принципи регуляції метаболічних шляхів
Усі хімічні реакції у клітині відбуваються за участі ферментів. Тому, щоб впливати на швидкість перебігу метаболічного шляху, достатньо регулювати кількість або активність ферментів. Звичайно, у метаболічних шляхах є ключові ферменти, завдяки яким відбувається регуляція швидкості всього шляху. Ці ферменти (один або декілька в метаболічному шляху) називаються регуляторними ферментами; вони каталізують, як правило, початкові реакції метаболічного шляху, необоротні реакції, швидкість-лімітуючі реакції (найповільніші) або реакції в місці перемикання метаболічного шляху (точка галуження).
Регуляція швидкості ферментативних реакцій здійснюється на 3 незалежних рівнях:
а) зміна кількості молекул ферменту;
б) доступність молекул субстрату і коферменту;
в) зміна каталітичної активності молекули ферменту.
Регуляція кількості молекул ферменту в клітині. Відомо, що білки в клітині постійно оновлюються. Кількість молекул ферменту в клітині визначається співвідношенням 2 процесів – синтезу та розпаду білкової молекули ферменту:

Синтез і фолдінг білка – багатостадійний процес. Регуляція синтезу білка може відбуватися на будь-якій стадії формування білкової молекули. Найбільш вивченим є механізм регуляції синтезу білкової молекули на рівні транскрипції, який здійснюється певними метаболітами, гормонами і рядом біологічно активних молекул.
Щодо розпаду ферментів, то регуляція цього процесу вивчена менше. Можна лише припускати, що це не просто процес протеолізу (руйнування білкової молекули), а складний механізм, який, можливо, визначається на генетичному рівні.
Регуляція швидкості ферментативної реакції доступністю молекул субстрату і коферментів. Важливим параметром, що контролює перебіг метаболічного шляху, є наявність субстратів, і головним чином – наявність першого субстрату. Чим більша концентрація вихідного субстрату, тим вища швидкість метаболічного шляху.
Інший параметр, що лімітує перебіг метаболічного шляху, – наявність регенерованих коферментів. Наприклад, у реакціях дегідрування коферментом дегідрогеназ слугують окислені форми NAD+, FAD, FMN, які відновлюються внаслідок реакції. Щоб коферменти знову приймали участь у реакції, є необхідною їхня регенерація, тобто перетворення на окислену форму.
Регуляція каталітичної активності ферментів. Найважливіше значення в зміні швидкості метаболічних шляхів відіграє регуляція каталітичної активності одного або кількох ключових ферментів даного метаболічного шляху. Це високоефективний і швидкий спосіб регуляції метаболізму.
Основні способи регуляції каталітичної активності ферментів
Алостерична регуляція. Алостеричними називають ферменти, активність яких регулюються не тільки кількістю молекул субстрату, але й іншими речовинами, які називаються ефекторами. Ефектори, що приймають участь в алостеричній регуляції, є клітинними метаболітами часто саме того шляху, регуляцію якого вони здійснюють.
Алостеричні ферменти відіграють важливу роль у метаболізмі, тому що вони надзвичайно швидко реагують на найменші зміни внутрішнього стану клітини. Алостерична регуляція має велике значення у наступних ситуаціях:
- під час анаболічних процесів. Інгібування кінцевим продуктом метабо-лічного шляху й активація початковими метаболітами дозволяють здійснювати регуляцію синтезу цих сполук;
- під час катаболічних процесів. У випадку накопичення АТФ у клітині відбувається інгібування метаболічних шляхів, що забезпечують отримання енергії. Субстрати при цьому використовуються на реакції резервування поживних речовин;
- для координації анаболічних і катаболічних шляхів. АТФ і АДФ – ало-стеричні ефектори, що діють як антагоністи;
- для координації паралельних і взаємопов’язаних метаболічних шляхів (наприклад, синтез пуринових і піримідинових нуклеотидів, що використовуються для синтезу нуклеїнових кислот). Таким чином, кінцеві продукти одного метаболічного шляху можуть бути алостеричними ефекторами іншого метаболічного шляху.
Ефектор, що викликає зниження (інгібування) активності ферменту, називають негативним ефектором, або інгібітором. Ефектор, що викликає підвищення (активацію) активності ферментів називають позитивним ефектором, або активатором.
Алостеричними ефекторами найчастіше слугують різноманітні метабо-літи. Кінцеві продукти метаболічного шляху часто є інгібіторами алостеричних ферментів, а вихідні речовини – активаторами. Це так звана гетеротропна регуляція. Такий вид алостеричної регуляції є дуже поширеним у біологічних системах.
Більш рідкісний випадок алостеричної регуляції, коли сам субстрат може виступати в якості позитивного ефектора. Така регуляція називається гомотропною (ефектор і субстрат – одна й та ж речовина). Такі ферменти мають кілька центрів зв’язування субстрату, які можуть виконувати подвійну функцію: каталітичну та регуляторну. Алостеричні ферменти такого типу використовуються у випадках, коли субстрат накопичується в надлишку й повинен швидко бути перетвореним на продукт.
Виявити ферменти з алостеричною регуляцією можна, вивчаючи кінетику цих ферментів. Ці ферменти не підпорядковуються законам Міхаеліса-Ментен, вони мають характерну S-подібну криву залежності швидкості реакції від концентрації субстрату.
Особливості будови та функціонування алостеричних ферментів:
- звичайно це олігомерні білки, що складаються з декількох протомерів або мають доменну будову;
- вони мають алостеричний центр, просторово віддалений від каталітично активного центру;
- ефектори приєднуються до ферменту нековалентно в алостеричних (регуляторних) центрах;
- алостеричні центри, так само, як і каталітичні, можуть проявляти різну специфічність до лігандів: вона може бути абсолютною й груповою. Деякі ферменти мають кілька алостеричних центрів, одні з яких специфічні до активаторів, а інші – до інгібіторів;
- протомер, на якому знаходиться алостеричний центр, – регуляторний протомер, на відміну від каталітичного протомеру, що містить активний центр, в якому відбувається хімічна реакція;
- алостеричні ферменти мають властивість кооперативності: взаємодія алостеричного ефектора з алостеричним центром викликає послідовну кооперативну зміну конформації всіх субодиниць, що призводить до зміни конформації активного центру й зміни спорідненості ферменту до субстрату, що збільшує або зменшує каталітичну активність ферменту (рис. 30);
- регуляція алостеричних ферментів є оборотною: від’єднання ефектора від регуляторної субодиниці відновлює вихідну каталітичну активність ферменту;
- алостеричні ферменти каталізують ключові реакції даного метаболічного шляху.
Швидкість метаболічних процесів залежить від концентрації речовин, що використовуються та утворюються в даному ланцюзі реакцій. Така регуляція є логічною, так як під час накопичення кінцевого продукту він (кінцевий продукт) може діяти як алостеричний інгібітор ферменту, який каталізує найчастіше початковий етап даного метаболічного шляху:

Фермент, що каталізує перетворення субстрату А на продукт В, має алостеричний центр для негативного ефектора, яким є кінцевий продукт метаболізму F. Якщо концентрація F збільшується (тобто речовина F синтезується швидше, ніж використовується), інгібується активність одного з початкових ферментів. Таку регуляцію називають негативним зворотнім зв’язком, або ретроінгібуванням. Негативний зворотній зв’язок – поширений механізм регуляції метаболізму в клітині.

| Рис. 30. | Схема, що пояснює роботу алостеричного ферменту: А – дія негативного ефектора (інгібітора); Б – дія позитивного ефектора (активатора). |
В центральних метаболічних шляхах вихідні речовини можуть бути активаторами ключових ферментів метаболічного шляху. Як правило, при цьому алостеричній активації піддаються ферменти, що каталізують кінцеві реакції метаболічного шляху:

В якості прикладу можна розглянути принцип регуляції гліколізу – специфічного (початкового) шляху розпаду глюкози (рис. 31). Один із кінцевих продуктів розпаду глюкози – молекула АТФ. При надлишку в клітині АТФ відбувається ретроінгібування алостеричних ферментів фосфо-фруктокінази і піруваткінази. Під час утворення великої кількості фрукто- зо-1,6-бісфосфату спостерігають алостеричну активацію ферменту піруват-кінази. Дякуючи такій регуляції здійснюється узгодженість протікання метаболічних шляхів розпаду глюкози.

| Рис. 31. | Схема позитивної і негативної регуляції катаболізму глюкози: Молекула АТФ приймає участь у ретроінгібуванні алостеричних ферментів фосфофруктокінази і піруваткінази. Фруктозо-1,6-бісфосфат – активатор метаболічного шляху розпаду глюкози. Плюсами позначена активація, мінусами – інгібування ферментів. |
Регуляція за допомогою білок – білкових взаємодій. Деякі ферменти змінюють свою каталітичну активність у результаті даних взаємодій. Розглянемо 2 механізми активації ферментів за допомогою білок-білкових взаємодій:
· активація ферментів у результаті приєднання регуляторних білків;
· зміна каталітичної активності внаслідок асоціації або дисоціації протомерів ферменту.
Активація ферментів в результаті приєднання регуляторних білків. Цей тип регуляції можна розглянути на прикладі активації ферменту аденілатциклази, локалізованої у плазматичній мембрані клітини.
Активний центр аденілатциклази локалізований на цитоплазматичній стороні плазматичної мембрани. Активована аденілатциклаза каталізує реакцію утворення з АТФ циклічного 3',5'-АМФ (цАМФ) – вторинного, внутрішньоклітинного посередника дії гормонів:

У мембрані аденілатциклаза функціонує в комплексі з іншими білками:
- рецептором гормону, що виступає в позаклітинне середовище та взаємодіє з гормонами;
- з G-білком, що займає проміжне положення між рецептором і ферментом аденілатциклазою. G-білок – олігомерний білок, що складається з трьох субодиниць – α, β, і γ. α-субодиниця має центр зв’язування й розщеплення ГТФ. Тому цей білок називається ГТФ-зв’язуючим білком, або G-білком;
- у результаті зв’язування гормону з рецептором відбувається зміна конформації G-білка, зменшення його спорідненості до молекули ГДФ, з якою він зв’язаний за відсутності гормонального сигналу, і збільшення спорідненості до ГТФ. Приєднання ГТФ викликає конформаційні зміни в G-білку і дисоціацію його на субодиниці: субодиницю α, зв’язану з ГТФ (α-ГТФ) і димер βγ;
- α-ГТФ має високу спорідненість до аденілатциклази, його приєднання призводить до активації останньої, тому α-ГТФ – регуляторний білок, а даний механізм активації аденілатциклази називають активацією ферментів в результаті приєднання регуляторних білків (рис. 32).
Регуляція каталітичної активності ферментів асоціацією/дисоціа-цією протомерів. Протеїнкінази – група ферментів, що каталізує перенесення залишку фосфорної кислоти з АТФ на специфічні ОН–групи амінокислотних залишків білків (викликають фосфорилювання білків). Механізми активації різних протеїнкіназ не є однаковими. В якості прикладу регуляції каталітичної активності ферментів асоціацією або дисоціацією протомерів можна навести регуляцію активності ферменту протеїнкінази А.
Протеїнкіназа А (цАМФ-залежна) складається з 4 субодиниць 2 типів: 2 регуляторні (R) та 2 каталітичні (С). Такий тетрамер не має каталітичної активності. Регуляторні субодиниці мають ділянки зв'язування для циклічного 3',5'–АМФ (цАМФ), по 2 на кожну субодиницю. Приєднання 4 молекул цАМФ до 2 регуляторних субодиниць спричиняє до зміни конформації регуляторних протомерів та до дисоціації тетрамерного комплексу, при цьому вивільнюється 2 активні каталітичні субодиниці (рис. 32). Такий механізм регуляції зворотній. Відщеплення молекул цАМФ від регуляторних субодиниць спричиняє до асоціації регуляторних та каталітичних субодиниць протеїнкінази А з утворенням неактивного комплексу.

| Рис. 32. | Регуляція активності аденілатциклази: Гормон (Г), взаємодіючи з рецептором (R) на поверхні клітин, призводить до зменшення спорідненості ГТФ-зв’язуючого білка (G-білка, що складається з протомерів α, β, γ) до ГДФ і збільшення спорідненості до ГТФ. Приєднання молекули ГТФ до активного центру G-білка викликає дисоціацію комплексу на субодиниці α-ГТФ і димер βγ. Комплекс α-ГТФ активує аденілатциклазу, що сприяє синтезу із АТФ внутрішньоклітинних регуляторних молекул цАМФ. АЦ – аденілатциклаза, ПКА – протеїнкіназа А, Рі –Н3РО4. |
Регуляція каталітичної активності ферментів шляхом фосфорилювання/дефосфорилювання. В біологічних системах часто зустрічається механізм регуляції активності ферментів за допомогою ковалентної модифікації амінокислотних залишків. Швидкий та широко розповсюджений спосіб хімічної модифікації ферментів – фосфорилювання/дефосфорилювання. Модифікації піддаються ОН–групи ферменту. Фосфорилювання відбувається ферментами протеїнкіназами, а дефосфорилювання – фосфопротеїнфосфатазами. Приєднання залишку фосфорної кислоти спричиняє до зміни конформації активного центра та його каталітичної активності. При цьому результат може бути двояким: одні ферменти при фосфорилюванні активуються, інші, навпаки, стають менш активними (рис. 33).

| Рис. 33. | Регуляція активності ферментів фосфорилюванням/дефосфорилюванням |
Зміни активності ферменту, що викликані фосфорилюванням, зворотні. Відщеплення залишку фосфорної кислоти здійснюється ферментами фосфопротеїнфосфатазами. Активність протеїнкіназ і фосфопротеїн-фосфатаз регулюється гормонами, що дозволяє швидко змінювати активність ключових ферментів метаболічних шляхів у залежності від умов зовнішнього середовища. Антагоністичні за функцією гормони протилежним чином впливають на фосфорилювання/дефосфорилювання ферментів, викликаючи протилежні ефекти змін метаболізму клітини. Наприклад, під дією глюкагону (у період між прийомами їжі) у клітинах відбувається зменшення синтезу енергетичного матеріалу – жиру, глікогену та посилення його розпаду (мобілізація), що викликаний фосфорилюванням ключових ферментів цих процесів. А під дією інсуліну (під час травлення), навпаки, активується синтез глікогену та інгібується його розпад, тому що взаємодія інсуліну з рецептором активує сигнальний шлях, що спричиняє до дефосфорилювання тих же ключових ферментів.
Регуляція каталітичної активності ферментів частковим (обмеженим) протеолізом. Деякі ферменти, що функціонують поза клітин (у ШКТ або плазмі крові), синтезуються у вигляді неактивних попередників і активуються лише в результаті гідролізу одного чи декількох певних пептидних зв'язків, що спричиняє до відщеплення частини білкової молекули попередника. В результаті в частині молекули, що залишилась відбувається конформаційна перебудова та формується активний центр ферменту.
Розглянемо механізм часткового протеолізу на прикладі активації протеолітичного ферменту трипсину (рис. 34). Трипсиноген, що синтезується в підшлунковій залозі, під час травлення по протокам підшлункової залози потрапляє в дванадцятипалу кишку, де й активується шляхом часткового протеолізу під дією ферменту кишечнику ентеропептидази. У результаті відщеплення гексапептиду з N-кінця формується активний центр у залишеній частині молекули. Потрібно нагадати, що трипсин відносять до родини «серинових» протеаз – активний центр ферменту містить функціонально важливий Сер.
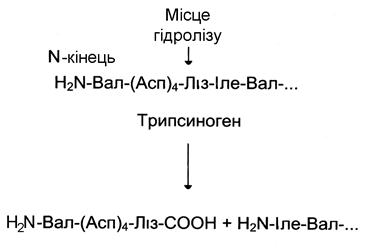
Гексапептид Трипсин
| Рис. 34. | Активація трипсину частковим протеолізом Під дією ферменту кишечнику ентеропептидази відбувається гідроліз пептидного зв’язку Ліз – Іле. У результаті відщеплення гексапептиду з N-кінця формується активний центр у залишеній частині молекули. |
Частковий протеоліз – приклад регуляції, внаслідок якої активність ферменту змінюється незворотне. Такі ферменти функціонують, як правило, протягом короткого часу, що визначається часом життя білкової молекули. Частковий протеоліз лежить в основі активації протеолітичних ферментів, білків системи згортання крові й фібринолізу, білків системи комплементу, а також пептидних гормонів.