 |
УРОВНИ СТРУКТУРНОЙ ОРГАНИЗАЦИИ БЕЛКОВЫХ МОЛЕКУЛ
Дата добавления: 2014-06-18 | Просмотров: 1652
|
|
Первичная структура — это конфигурация полипептидной цепи, которая формируется в результате образования пептидной связи между остатками АК (рис. 1.1).
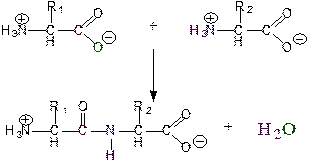
Рис. 1.1. Образование пептидной связи
Постулаты (принципы формирования пептидной связи), сформулированные Л. Поллингом и Р. Кори:
1) атомы, образующие пептидную связь, копланарны (расположены в одной плоскости); вращение атомов или групп атомов вокруг пептидной связи невозможно;
2) принцип эквивалентности вклада АК-остатков в образование пептидной связи и, тем самым, в образование полипептидной цепи (исключение пролин);
3) принцип максимума водородных связей.
Первичную структуру белка стабилизируют (поддерживают):
- пептидные связи (между АК-остатками);
- дисульфидные связи (между свободными –SH-группами цистеина).
Первичная структура белка генетически детерминирована и несет информацию о его пространственной структуре.
Вторичная структура белка —локальная конформация, обусловленная вращением отдельных участков полипептидной цепи вокруг одинарных ковалентных связей.
Основные связи, которые стабилизируют вторичную структуру, — водородные.
Виды вторичной структуры (рис. 1.2):
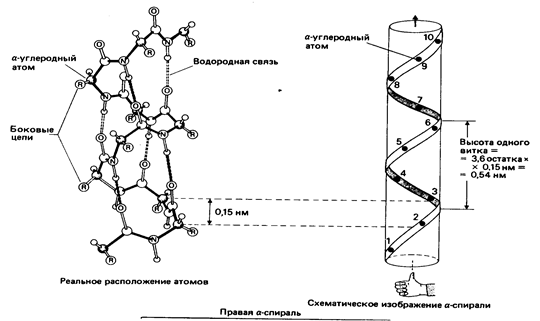 |
– α-спираль(правозакрученная)
Рис. 1.2. Виды вторичной структуры белка (начало, окончание см. на с. 9)
– β-структура–β-слой

– β-поворот
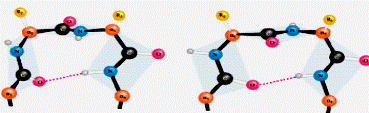
Рис. 1.2. Виды вторичной структуры белка (окончание, начало см. на с. 8)
 Несколько участков полипептидной цепи, организованных в пространстве в форме a-спирали или b-структуры, могут объединяться, формируя надвторичную структуру. В результате в молекуле белка образуются домены (функциональные или структурные) (рис. 1.3).
Несколько участков полипептидной цепи, организованных в пространстве в форме a-спирали или b-структуры, могут объединяться, формируя надвторичную структуру. В результате в молекуле белка образуются домены (функциональные или структурные) (рис. 1.3).
 Третичная структура белка —это расположение в пространстве всей полипептидной цепи, отдельные участки которой имеют собственную локальную конформацию. Этапы формирования третичной структуры белка представлены на рисунке 1.4.
Третичная структура белка —это расположение в пространстве всей полипептидной цепи, отдельные участки которой имеют собственную локальную конформацию. Этапы формирования третичной структуры белка представлены на рисунке 1.4.
Поддержанию третичной структуры белка способствуют гидрофобные связи, которые образуются внутри молекулы. В образовании этих связей принимают участие неполярные радикалы аминокислот. Могут также образовываться другие нековалентные связи.
У белка, имеющего третичную структуру, на поверхности молекулы формируется участок, который может присоединять к себе другие молекулы, называемые лигандами. Этот участок называется активный центр и формируется из радикалов аминокислот, которые сближаются друг с другом при формировании третичной структуры. Высокая специфичность взаимодействия белка с лигандом обеспечивается комплементарностью структуры активного центра структуре лиганда.
Четвертичная структураформируется при объединении нескольких полипептидных цепей, имеющих третичную структуру
(рис. 1.5). Образованный таким образом белок обладает новой функцией.


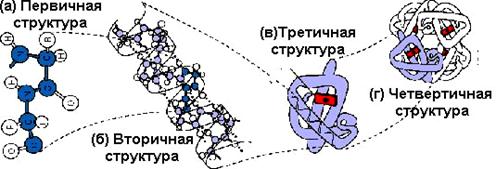
Рис. 1.5. Формирование четвертичной структуры белка
Белки с четвертичной структурой называются олигомерными, а составляющие их индивидуальные полипептидные цепи — протомерами (мономерами, субъединицами). Такие соединения стабилизируются водородными связями и электростатическими взаимодействиями между АК-остатками, расположенными на поверхности протомеров. Белки с четвертичной структурой — гемоглобин, ферменты лактатдегидрогеназа, РНК-полимераза, вирус табачной мозаики.
Преимущества белков с четвертичной структурой:
1) экономия генетического материала;
2) уменьшение числа ошибок при синтезе белка;
3) разнообразие белков;
4) появление у белков новых функций.