 |
Тема 5. РЕГУЛЯЦИЯ АКТИВНОСТИ ФЕРМЕНТОВ
Дата добавления: 2014-06-18 | Просмотров: 1901
|
|
Принципы регуляции химических процессов в клетке
Изменить скорость химического процесса в клетке можно путем: а) изменения количества субстрата или продукта реакции (регуляция проницаемости мембран); б) изменения количества фермента (регуляция синтеза белков); в) изменения активности фермента. Ниже будут приведены механизмы регуляции активности фермента. Можно выделить три основных принципа специфической регуляции активности ферментов: изостерическая регуляция, аллостерическая регуляция и ковалентная модификация структуры ферментов.
Влияние ингибиторов
Ингибиторы ферментов — это вещества, замедляющие ферментативные реакции
(рис. 5.1).

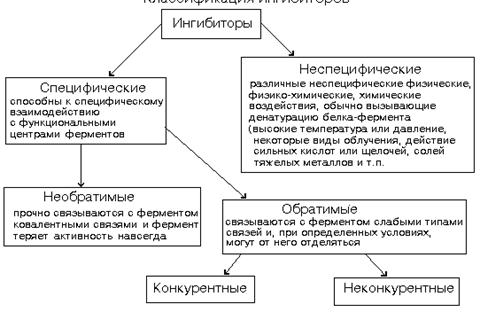
Рис. 5.1. Классификация ингибиторов ферментов
Конкурентные (изостерические) ингибиторы имеют следующие характеристики:
а) они похожи по структуре на субстрат (изо — подобный); б) эффект конкурентного ингибитора может быть устранен избытком субстрата (Vmax не изменяется, а соответствующая Km увеличивается). Как субстрат, так и ингибитор связываются с ферментом в активном центре, и связывание там одного из них исключает связывание второго.
Неконкурентные ингибиторы имеют следующие характеристики: а) ингибитор не похож по структуре на субстрат; б) эффект неконкурентного ингибитора не может быть устранен избытком субстрата (Vmax уменьшается, а Km остается неизменной). Связывание ингибитора с ферментом не влияет на связывание субстрата с ферментом.
Ингибитор (I) может связываться как с ферментом (Е), так и с фермент-субстратным комплексом (ES), но только ES-комплекс (а не ESI-комплекс) ведет к образованию продукта.
 По аналогии с изостерическими этот вид ингибиторов должен быть назван аллостерическим (аллос — иной, другой), однако термин «аллостерический» закрепился за регуляторами, действующими на мультимерные ферменты, субъединицы которых кооперативно реагируют на связывание регулятора с аллостерическим центром. При связывании регулятора с аллостерическим центром происходит изменение конформации фермента, которое может оказать значительное влияние на связывание субстрата и скорость реакции (рис. 5.2).
По аналогии с изостерическими этот вид ингибиторов должен быть назван аллостерическим (аллос — иной, другой), однако термин «аллостерический» закрепился за регуляторами, действующими на мультимерные ферменты, субъединицы которых кооперативно реагируют на связывание регулятора с аллостерическим центром. При связывании регулятора с аллостерическим центром происходит изменение конформации фермента, которое может оказать значительное влияние на связывание субстрата и скорость реакции (рис. 5.2).