 |
Вплив дисперсності на рівновагу хімічних реакцій
Дата добавления: 2014-10-03 | Просмотров: 1753
|
|
Ступінь дисперсності впливає і на рівновагу в хімічних реакціях:
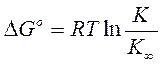 ( 3.27)
( 3.27)
DGo – додаткова реакційна здатність.
К - константа рівноваги для подрібнених частинок.
К∞ - константа рівноваги для крупних частинок.
Зі збільшенням дисперсності збільшується активність компонентів.
Наприклад для реакції
CaCO3 = CaO + CO2
зі зростанням подрібненості СаСО3, рівновага в реакції зсувається вправо, а збільшення дисперсності СаО приводить до зсуву рівноваги в реакції вліво.
Контрольні питання:
1. Якими параметрами характеризується ступінь подрібнення речовини і який зв’язок між цими параметрами?
2. Дайте означення поняття “питома поверхня”. В яких одиницях вона вимірюється і як пов’язана з дисперсністю?
3. Як впливає кривизна поверхні і природа рідини на її внутрішній тиск?
4. Що відбудеться з двома мильними бульбашками різних розмірів, якщо їх з’єднати трубочкою?
5. Яке рівняння слід використати для визначення тиску в сферичній дощовій краплині? Порівняйте цей тиск з тиском в об’ємі води.
6. Якими причинами зумовлено підняття (опускання) рідини в капілярах?
7. Чому в капілярах пара конденсується при більш низькому тиску, ніж на пласкій поверхні?
8. Як залежить температура агрегатного перетворення від дисперсності конденсованої фази?
9. Наведіть та проаналізуйте рівняння залежності тиску насиченої пари рідини від ступеня викривлення її поверхні.
10. Як впливає дисперсність речовини на розчинність та реакційну здатність речовин?
11. Що буде відбуватися з твердими частинками неправильної форми в ненасиченому розчині?
З якою метою землероби в посуху подрібнюють верхній шар ґрунту?