 |
Теорія полімолекулярної адсорбції БЕТ
Дата добавления: 2014-10-03 | Просмотров: 1947
|
|
Дослідження процесів адсорбції газів на поверхні твердих тіл показали, що ізотерми Ленгмюра є характерними для систем, в яких відбувається сильна взаємодія адсорбованих молекул з активними центрами поверхні, наприклад, при хемосорбції. У більшості випадків процес накопичення молекул на поверхні не закінчується утворенням мономолекулярного шару. Молекули продовжують адсорбуватися в другому, третьому та подальших шарах, з утворенням полімолекулярної плівки. При тисках близьких до тиску насиченої пари ps величина адсорбції різко зростає і процес закінчується об’ємною конденсацією пари. Для таких процесів ізотерма адсорбції має S-подібний вигляд (рис.24).

Рис. 24. Ізотерма полімолекулярної адсорбції.
У 1935-40 рр. Брунауер, Еммет та Теллер запропонували теорію полімолеклярної адсорбції, яка згодом отримала назву теорія БЕТ (згідно перших букв прізвищ її засновників). Ця теорія ґрунтується на наступних положеннях:
1. На поверхні адсорбенту є певна кількість рівноцінних в енергетичному відношенні активних центрів, що утримують молекули адсорбату.
2. Взаємодією молекул адсорбованих на сусідніх адсорбційних центрах нехтують.
3. Кожна адсорбована молекула є центром адсорбції для наступного шару.
4. Статистична сума станів молекул у всіх шарах крім першого така сама, як і в рідкому стані.

Рис. 25. Схема полімолекулярної адсорбції.
Полімолекулярну адсорбцію можна представити за допомогою послідовних псевдохімічних реакцій:
A’ + B = A’B; A’B + B = A’B2; A’B2 + B = A’B3 і т.д.
Константи рівноваги цих реакцій:
 ;
; 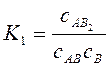 ;
; 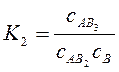 ;... ( 4.46)
;... ( 4.46)
сAB = A1 – адсорбція в першому шарі молекул.
сAB2 = A2– адсорбція в другому шарі молекул.
сAB3 = A3– адсорбція в третьому шарі молекул.
сB =р – концентрація (для газів парціальний тиск) адсорбату в об’ємі системи.
сA =A0 - число вільних адсорбційних центрів.
З виразів для константи рівноваги можна отримати рівняння, що виражають концентрацію відповідних комплексів на поверхні:
A1 = KAop
A2 = K1A1p = KK1Aop2
A3 = K2A2p = KK1K2Aop3 ( 4.47)
Згідно припущення теорії БЕТ всі шари на поверхні, крім першого, являють собою рідину. Тому взаємодія між молекулами така ж сама, як і при їх конденсації.
K1 = K2 = K3 = …= KL ( 4.48)
KL – константа конденсації пари.
KL =ар/аг; ар = 1; аг = рs; KL = 1/ps ( 4.49)
ар, аг - активності компонентів рідкої та газової фази.
Введемо наступні позначення:
C = K/KL ; x = p/ps ( 4.50)
Стала С відповідає різниці енергій Гіббса процесів адсорбції і конденсації.
-DG = RTlnC = RTlnK – RTlnKL ( 4.51)
Загальна кількість активних центрів адсорбенту дорівнює:
A∞ = Ao + A1 + A2 + A3 + … = Ao + AoCx + AoCx2+ AoCx3 =
= Ao[1 + Cx(1+ x + x2 + …)] ( 4.52)
В зв’язку з тим, що х<1:
(1 + x + x2 + …) = 1/(1 – x) ( 4.53)
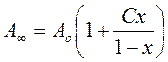 ( 4.54)
( 4.54)
Величина адсорбції дорівнює кількості адсорбату, адсорбованого в усіх шарах:
A = A1 + A2 + A3 + … = AoCx + 2AoCx2 + 3AoCx3 + … =
= AoCx(1 + 2x + 3x2 + …) ( 4.55)
При умові, що х<1:
(1 + 2x + 3x2 + …) = 1/(1 – x)2 ( 4.56)
 ( 4.57)
( 4.57)
Підставимо в цей вираз рівняння (4.51), та замінимо х=p/ps отримуємо рівняння ізотерми адсорбції БЕТ.
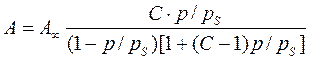 ( 4.58)
( 4.58)
Рівняння БЕТ добре застосовується в області тисків:
0,05< р/рS <0,3
При р/рS <0,05 стає відчутним вплив неоднорідності поверхні.
При р/рS >0,3 починається взаємодія між собою адсорбованих молекул.
В області малих значень тисків р/рS<<1 рівняння ізотерми адсорбції БЕТ перетворюється на рівняння ізотерми адсорбції Ленгмюра:
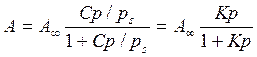
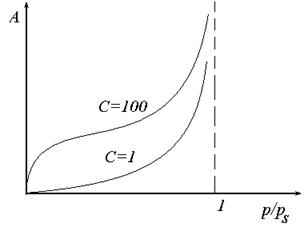
Рис. 26. Ізотерма адсорбції БЕТ.
Вигляд ізотерми адсорбції БЕТ залежить від відношення констант рівноваги адсорбції та конденсації С. З ростом цього відношення зростає взаємодія між адсорбатом і адсорбентом і залежність адсорбції від тиску зростає більш стрімко (рис.26).
З наближенням р до рS число вільних активних центрів зменшується, а кратність комплексів на поверхні зростає. При р=рS відбувається об’ємна конденсація пари.
При обробці експериментальних даних рівняння БЕТ зручно використовувати в лінійній формі:
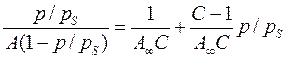 ( 4.59)
( 4.59)
Лінійна форма рівняння дозволяє графічним методом визначити його константи А∞ і С.
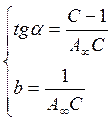

Рис. 27. Ізотерма адсорбції БЕТ в лінійних координатах.
Приклад 4.3
При дослідженні адсорбції азоту на рутилі при 75К отримана прямолінійна залежність: (p/ps)/[A(1-p/ps)] = f(p/ps). Пряма відсікає на осі ординат відрізок b=0,027 (кг/моль), а тангенс кута її нахилу становить tgα = 2,610(кг/моль); Запишіть рівняння, яке описує дану ізотерму і розрахуйте константи рівняння та питому поверхню адсорбенту, якщо відомо, що площа, яку займає одна молекула азоту S0 = 0,16нм2.
Адсорбція описується рівнянням БЕТ, яке в лінійній формі має вигляд :

(1/А∞С) = 0,027 (кг/моль); (С-1/ А∞С) = 2,61 (кг/моль);
Константи рівняння БЕТ дорівнюють:
С = 97,7; А∞ = 37,9∙10-2 (моль/кг)
Визначимо питому поверхню адсорбенту:
Sпит = A∞NAS0 = 37,9∙10-2∙6,023∙1023∙16∙10-20 = 36,51∙103 (кг/м2)